 |
Термодинамика и возможность химических превращений.
|
|
|
|
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКАрассматривает взаимосвязи между работой и энергией применительно к химическим превращениям. Поскольку химическое превращение обычно сопровождается высвобождением или поглощением определенного количества теплоты, оно, как и другие явления природы (в том числе электрические и магнитные), сопровождающиеся тепловыми эффектами, подчиняется фундаментальным принципам (началам) термодинамики. Химическая термодинамика определяет, в первую очередь, условия (такие, как температура и давление) протекания химических реакций и равновесных состояний, которых они достигают. Анализ тепловых явлений базируется на трех фундаментальных принципах, подтвержденных данными многочисленных наблюдений.
При движении быстрой частицы в газовой, жидкой или твердой среде происходит ионизация молекул. Если за время 10^-13 сек эклектроны и ионы рекомбинируют, то направление хим процессов и состав продуктов будут определяться в основном другими процессами. Если же ионы каким-либо образом разделились в системе, то возникает возможность химических превращений через ионные процессы.
рекомбинация с электроном: 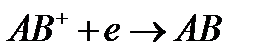
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
константа равновесия Кр, равна отношению констант скорости прямой и обратной реакций: можно получить из принципа ЛеШателье:
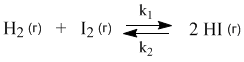
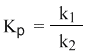
Равновесная степень превращения (X*) называется степень превращения исходных веществ в продукты реакции, отвечающая состоянию устойчивого равновесия системы. Равновес. степень превращ характеризует глубину протекания проц, степень приближ его результатов к оптимальным в данных условиях. Она функционально связана с константой равновесия, причем характер этой зависимости определяется порядком реакции.
|
|
|
Равновесная степень превращения исходной газовой смеси растет с увеличением давления и уменьшается с повышением температуры. На примере метанола: при низких температурах равновесие смещено в сторону метанола, но реакция протекает слишком медленно. Для увеличения скорости используют катализаторы, которые становятся активными только при 300-400*С (цинк-хромовый катализатор), когда константа равновесия очень мала. Приходится постепенно повышать давление, что способствует не только росту степени превращения, но и подавляет протекание побочных реакций.
10)КИНЕТИКА ХИМИЧЕСКИХ ПРЕВРАЩЕНИЙ ИЗУЧАЕТ закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Формальное кинетическое уравнение включает в левой части выражение скорости реакции в дифференциальном или алгебраическом виде в зависимости от типа реактора, а в правой части – ф-ю зависимости скорости реакции от концентрации реагентов. Кинетические закономерности сложных реакций описываются, как правило, системой из S дифференциальных или алгебраических уравнений для каждой из S независимых реакций.
Т. е. для реакцииаА + bВ + dD +... ––> еЕ +...можно записать: 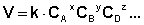
Уравне́ниеАрре́ниуса устанавливает зависимость константы скорости 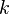 химической реакции от температуры
химической реакции от температуры 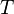 .
.
Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации 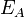 ), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией
), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией 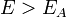 , пропорционально
, пропорционально 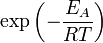 . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
|
|
|
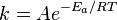
Здесь 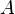 характеризует частоту столкновений реагирующих молекул,
характеризует частоту столкновений реагирующих молекул, 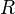 — универсальная газовая постоянная.
— универсальная газовая постоянная.
В рамках теории активных соударений 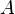 зависит от температуры, но эта зависимость достаточно медленная:
зависит от температуры, но эта зависимость достаточно медленная:
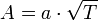
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений 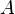 на 10 %.
на 10 %.
В рамках теории активированного комплекса получаются другие зависимости 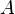 от температуры, но во всех случаях более слабые, чем экспонента.
от температуры, но во всех случаях более слабые, чем экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
11.ОБРАТИМЫЕ ЭКЗОТЕРМИЧЕСКИЕ РЕАКЦИИ: А «А* R + Q. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СТЕПЕНЬ И СКОРОСТЬ ХИМИЧЕСКОГО ПРЕВРАЩЕНИЯ. ГРАФИЧЕСКАЯ ЗАВИСИМОСТЬ. ОБОСНОВАНИЕ ОПТИМАЛЬНОГО ТЕМПЕРАТУРНОГО РЕЖИМА. ПРИМЕРЫ
Для изучения влияния температуры на скорость обратимой реакции рассмотрим зависимость  при
при 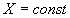 , то есть при заданном составе реакционной смеси. Сначала рассмотрим случай для обратимой экзотермической реакции. Для этого воспользуемся
, то есть при заданном составе реакционной смеси. Сначала рассмотрим случай для обратимой экзотермической реакции. Для этого воспользуемся  диаграммой (см. рис. 4
диаграммой (см. рис. 4 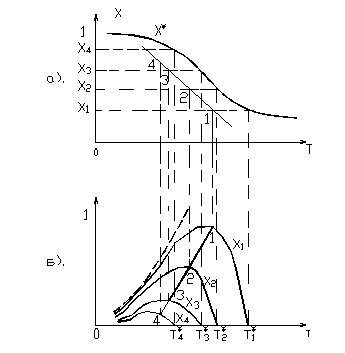
Рис. 4  диаграмма а).и зависимость скорости реакции от температуры при различных степенях превращения от б).
диаграмма а).и зависимость скорости реакции от температуры при различных степенях превращения от б).
Кривая 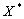 дает равновесные степени превращения при различных температурах. Каждая из горизонтальных линий (пунктирных), проведенных при различных фиксированных степенях превращениях, отвечает состояниям процесса при заданной
дает равновесные степени превращения при различных температурах. Каждая из горизонтальных линий (пунктирных), проведенных при различных фиксированных степенях превращениях, отвечает состояниям процесса при заданной 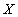 и разных температурах.
и разных температурах.
Будем двигаться по одной из линий, например 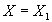 слева на право и определять значения скорости реакции (рис. 4б). При малых значениях
слева на право и определять значения скорости реакции (рис. 4б). При малых значениях 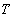 далеких от
далеких от 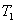 , при которой
, при которой 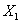 будет являться равновесной, скорость реакции будет определяться, в основном, скоростью прямой и возрастать с ростом температуры почти экспоненциально (пунктир на рис. 4б)).
будет являться равновесной, скорость реакции будет определяться, в основном, скоростью прямой и возрастать с ростом температуры почти экспоненциально (пунктир на рис. 4б)).
|
|
|
По мере продвижения по линии 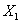 вправо, то есть с увеличением температуры, будем приближаться к равновесной линии, что означает усиление влияния обратной реакции, и зависимость
вправо, то есть с увеличением температуры, будем приближаться к равновесной линии, что означает усиление влияния обратной реакции, и зависимость  будет все больше отклоняться от экспоненциальной. Для обратимой экзотермической реакции (
будет все больше отклоняться от экспоненциальной. Для обратимой экзотермической реакции ( ) скорость обратной реакции с ростом температуры увеличивается сильнее, чем скорость прямой. Начиная с некоторой температуры возрастание скорости обратной реакции будет превалировать над возрастанием скорости прямой. Как результат – скорость обратимой реакции начнет уменьшаться с ростом температуры., пока не станет равной нулю при
) скорость обратной реакции с ростом температуры увеличивается сильнее, чем скорость прямой. Начиная с некоторой температуры возрастание скорости обратной реакции будет превалировать над возрастанием скорости прямой. Как результат – скорость обратимой реакции начнет уменьшаться с ростом температуры., пока не станет равной нулю при 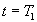 , когда
, когда 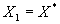 . Таким образом, зависимость
. Таким образом, зависимость  в данном случае имеет экстремальный характер и проходит через максимум.
в данном случае имеет экстремальный характер и проходит через максимум.
Температура, при которой скорость обратимой реакции достигает максимума при заданной степени превращения, называется оптимальной температурой (*- на кривых  и диаграмме
и диаграмме  ).
).
Выполнив подобные действия несколько при различных степенях превращения 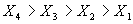 и соединив точки оптимальных температур, получим линию оптимальных температур (ЛОТ) – значения
и соединив точки оптимальных температур, получим линию оптимальных температур (ЛОТ) – значения 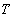 , при которых скорость реакции при каждой фиксированной
, при которых скорость реакции при каждой фиксированной 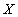 достигает максимального значения.
достигает максимального значения.
|
|
|


