 |
Требования к размерам зерен и пористости катализатора в зависимости от области протекания гетерогенно-каталитического процесса.
|
|
|
|
Катализаторы – это вещества, которые многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют её механизм и увеличивают скорость реакции; при этом они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий. 
| Влияние катализатора на механизм реакции можно пояснить на условном примере. Пусть протекает одностадийная реакция с энергией активации Е0=A+B=R. Ход реакции изображён на энергетической диаграмме 1. в присутствии катализатора она протекает через несколько последовательных стадий: А+Кт → Акт+В → RКт → R+Кт IстадияIIстадия III стадия |
Каждая из стадий характеризуется своей энергией активации, но, как правило, каждое значение энергии активации Е1, Е2, Е3 меньше, чем Е0, то есть в присутствии катализатора реакция протекает по более выгодному пути, что позволяет проводить процесс с большей скоростью. Исходное (I) и (II) конечное энергетические состояния реакционной системы в присутствии катализатора и без него остаются одинаковыми; следовательно: катализатор не может изменить состояние химического равновесия, которое не зависит от пути реакции. Каталитические процессы могут быть гомогенными и гетерогенными. Последние наиболее распространены. Учёные постоянно работают над совершенствованием катализаторов и самих каталитических процессов.
Характеристики катализаторов. Твёрдые катализаторы – это, как правило, высокопористые вещества с развитой внутренней поверхностью, характеризующиеся кристаллической структурой, активностью, селективностью и рядом других технологических характеристик. Рассмотрим некоторые из них:
Активность катализатора – мера ускоряющего воздействия по отношению к данной реакции. Если каталитическая реакция и некаталитическая имеют один и тот же порядок, то есть их константы имеют одну и ту же размерность, то активность катализатора (А) можно определить:
|
|
|
А=ККТ/К=КоКТexp(-E’/RT)/K0exp(-E/RT).
Из формулы следует, что активность катализатора тем выше, чем больше снижается энергия активации. Рост активности за счёт снижения энергии активации сдерживается уменьшением К0КТ по сравнению с К0 (то есть имеет место так называемый компенсационный эффект).
Температура зажигания – это температура, при которой технологический процесс начинает идти с достаточной для практической цели скоростью. Понятие “зажигание” означает скачкообразное увеличение скорости реакции. С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания. Для экзотермической реакции температура зажигания – это минимальная температура, при которой процесс может идти без подвода теплоты извне, то есть в автоматическом режиме.
Селективностью или избирательностью катализатора называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных. Количественно селективность катализатора можно оценить как селективность процесса (см. ранее) – интегральную или дифференциальную. Если одновременно протекают несколько химических реакций (параллельных), то можно подобрать разные селективные катализаторы для каждой из этих реакций. Например:
-в присутствии оксида алюминия этанол разлагается преимущественно на этилен и воду: C2H5OH→C2H4+H2O,
-в присутствии серебра, меди и других металлов практически имеет место реакция дегидрирования спирта с образованием уксусного альдегида: C2H5OH→ CH3CHO+H2,
-в присутствии смешанного катализатора (Al2O3+ZnO) с достаточно высокой селективностью идут реакции дегидратации и дегидрирования с образованием бутадиена: 2C2H5OH→C4H6+2H2O+H2.
|
|
|
Селективность зависит от пористой и кристаллической структуры катализатора. Пористость значительно увеличивает скорость химических реакций. Стараются применять или искусственные высокопористые адсорбенты (алюмосиликаты, цеолиты, активированный уголь и т.д.). их используют, как носители, на которые наносят активные компоненты.
Наряду с пористой структурой большое значение имеет кристаллическая структура катализаторов. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающиеся каталитической активностью. Например, переход γ-Al2O3в форму α-Al2O3 на несколько порядков снижает активность этого вещества.
Часто введение очень небольшого количества (долей процента) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности, либо, наоборот, к снижению активности на несколько порядков. В первом случае говорят о промотировании, во втором – об отравлении катализатора. Механизм действия промотеров и ядов следующий: первые образуют (раскрывают) активные центры, вторые блокируют их.
Основные стадии и кинетические особенности гетерогенно-каталитических процессов.
Гетерогенно-каталитическая реакция на поверхности твёрдого катализатора – это сложный многостадийный процесс.
1 стадия. Как и в гетерогенном некаталитическом процессе, сначала происходит диффузия газообразного реагента из основного потока к внешней поверхности зерна катализатора через газовую плёнку, в которой концентрация реагента ниже, а концентрация продукта выше, чем в основном потоке. Это стадия внешней диффузии.
2 стадия. Основная часть молекул газообразного реагента диффуизирует внутри пор катализатора – стадия внутренней диффузии. Скорость диффузии молекул через пористую стенку значительно меньше скорости их поступательного движения.
3 стадия. Молекулы реагента адсорбируются на поверхности катализатора – адсорбция. Катализатор – сорбент, газ – сорбат. Различают физическую адсорбцию и хемосорбцию. При хемосорбции связь сорбент-сорбат более сильная. Очень сильная связь приводит к снижению скорости основной реакции, поэтому сила связи при хемосорбции должна быть сравнима с таковой при физической адсорбции, но сильнее её. Если химическая связь очень слабая, такая же, как при физической адсорбции, то не происходит разрыхления связей в молекуле сорбата, приводящее к снижению энергии активации при каталитическом процессе в сравнении с некаталитическим.
|
|
|
4 стадия. Вслед за адсорбцией происходит поверхностная химическая реакция, которая заключается либо в перегруппировке активированного комплекса, либо во взаимодействии одного адсорбированного реагента с молекулами другого реагента. В результате поверхностной реакции образуется адсорбированный продукт.
5 стадия. Процесс десорбции продукта с поверхности катализатора. При этом энергия связи продукта с сорбентом должна быть меньше чем энергия связи сорбата и сорбента.
-Стадии 3, 4 и 5 являются центральными.
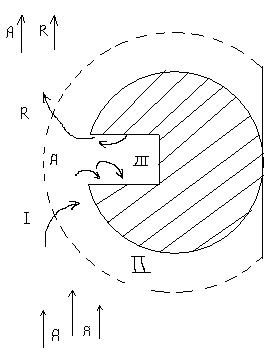
| Схематическое изображение участка зерна катализатора: I–поток газа, обтекающий зерно катализатораII – пограничная газовая плёнкаIII – пора внутри катализатораR – продукт реакции, А – исходный реагент 6 стадия. Десорбированные газообразные продукты диффуидируют из пор к внешней поверхности катализатора – обратная внутренняя диффузия 7 стадия. Газообразные продукты диффуидируют от поверхности катализатора в газовый поток через пограничную плёнку, окружающую зерно катализатора – внешняя диффузия. |
25. ТЕХНОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ ТВЕРДЫХ КАТАЛИЗАТОРОВ: АКТИВНОСТЬ, ТЕМПЕРАТУРА ЗАЖИГАНИЯ, СЕЛЕКТИВНОСТЬ, СТРУКТУРА, СОСТАВ. ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К КАТАЛИЗАТОРАМ.
Твёрдые катализаторы – это высокопористые вещества с развитой внутренней поверхностью, характеризующиеся кристаллической структурой, активностью, селективностью и рядом других технологических характеристик.
Активность катализатора – мера ускоряющего воздействия по отношению к данной реакции. Если каталитическая реакция и некаталитическая имеют один и тот же порядок, то есть их константы имеют одну и ту же размерность, то активность катализатора (А) можно определить:
|
|
|
А=ККТ/К=КоКТexp(-E’/RT)/K0exp(-E/RT).
Из формулы следует, что активность катализатора тем выше, чем больше снижается энергия активации. Рост активности за счёт снижения энергии активации сдерживается уменьшением К0КТ по сравнению с К0 (то есть имеет место так называемый компенсационный эффект).
Температура зажигания – это температура, при которой технологический процесс начинает идти с достаточной для практической цели скоростью. Понятие “зажигание” означает скачкообразное увеличение скорости реакции. С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания. Для экзотермической реакции температура зажигания – это минимальная температура, при которой процесс может идти без подвода теплоты извне, то есть в автоматическом режиме.
Селективностью или избирательностью катализатора называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных. Количественно селективность катализатора можно оценить как селективность процесса (см. ранее) – интегральную или дифференциальную. Если одновременно протекают несколько химических реакций (параллельных), то можно подобрать разные селективные катализаторы для каждой из этих реакций. Например:
-в присутствии оксида алюминия этанол разлагается преимущественно на этилен и воду: C2H5OH→C2H4+H2O,
-в присутствии серебра, меди и других металлов практически имеет место реакция дегидрирования спирта с образованием уксусного альдегида: C2H5OH→ CH3CHO+H2,
-в присутствии смешанного катализатора (Al2O3+ZnO) с достаточно высокой селективностью идут реакции дегидратации и дегидрирования с образованием бутадиена: 2C2H5OH→ C4H6+2H2O+H2.
Селективность зависит от пористой и кристаллической структуры катализатора. Пористость значительно увеличивает скорость химических реакций. Стараются применять или искусственные высокопористые адсорбенты (алюмосиликаты, цеолиты, активированный уголь и т.д.). их используют, как носители, на которые наносят активные компоненты.
Наряду с пористой структурой большое значение имеет кристаллическая структура катализаторов. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающиеся каталитической активностью. Например, переход γ-Al2O3 в форму α-Al2O3 на несколько порядков снижает активность этого вещества.
Часто введение очень небольшого количества (долей процента) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности, либо, наоборот, к снижению активности на несколько порядков. В первом случае говорят о промотировании, во втором – об отравлении катализатора. Механизм действия промотеров и ядов следующий: первые образуют (раскрывают) активные центры, вторые блокируют их.
|
|
|
Требования, предъявляемые к катализаторам. Катализаторы, используемые в промышленности, должны обладать постоянной высокой каталитической активностью, селективностью, механической прочностью, термостойкостью, большой длительностью работы, легкой регенерируемостью, незначительной стоимостью. Эти требования относятся к катализаторам для гетерог. катализа. Единой теории подбора катализаторов не существует. Многие катализаторы, широко применяемые в пром-сти, подобраны эмпирич. путем.
|
|
|


