 |
Способы выражения концентрации растворов.
|
|
|
|
Методические указания к выполнению практического занятия по теме «Растворы» для студентов лечебного, педиатрического и стоматологического факультетов.
Растворы имеют большое значение как в медицине. Растворами являются плазма крови, спинно-мозговая жидкость, лимфа и.т.д. Лекарственные вещества эффективны лишь в растворенном состоянии в организме, все биохимические реакции протекают в растворах. В связи с этим необходимо определять концентрации веществ в различных биологических жидкостях и лекарственных препаратах. Для этого широко применяют метод титриметрического анализа, который изложен в следующей лекции.
Растворы - гомогенные (однородные) системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия. Вещества, составляющие раствор, называют компонентами реакции. Растворителем считают тот компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. Например, в водном растворе глюкозы (твердое вещество) растворителем является вода.
По агрегатному состоянию растворы могут быть газообразными, жидкими и твердыми.
Классификация растворов. Растворы веществ с молекулярной массой меньше 5000г/моль называют растворами низкомолекулярных соединений (НМС), больше 5000 г/моль - растворы высокомолекулярных соединений (ВМС).
По наличию или отсутствию электролитической диссоциации растворы НМС подразделяют на три класса - растворы электролитов, неэлектролитов.
Растворы электролитов - растворы диссоциирующих на ионы солей, кислот и оснований. Электропроводность растворов электролитов выше, чем растворителя. Например, растворы KNO3, НCl, KOH.
Растворы неэлектролитов - растворы веществ, практически не диссоциирующих в воде. Например, растворы сахарозы, глюкозы, мочевины. Электропроводность растворов неэлектролитов мало отличается от растворителя.
|
|
|
В лабораторной практике различают концентрированные растворы (содержание растворенного вещества соизмеримо с содержанием растворителя) и разбавленные растворы (содержание растворенного вещества мало по сравнению с содержанием растворителя).
Иногда растворы определяют как дисперсные системы. При этом растворитель, в котором распределено вещество, называется дисперсной средой, а частицы растворенного вещества - дисперсной фазой. По степени дисперсности различают:
| Грубодисперсные системы (взвеси) | Коллоидные системы (кровь, лимфа, слюна, белки) | Истинные растворы (раствор соли в воде) |
| Размер частиц дисперсной фазы | ||
| Больше 100 нм | 1-100 нм | меньше 1 нм |
Таким образом, если одно вещество диспергировать (разрушать) в другом, то, в зависимости от размера частиц диспергируемого вещества, можно получить системы трёх типов:
I. Взвеси – это дисперсные системы, в которых размеры распределённых частиц сравнительно велики (10 –7 – 10 –5 м). Взвеси делятся на суспезии и эмульсии; в первых распределённое вещество твёрдое, во вторых – жидкое. Частицы взвесий видны простым глазом или в обычный оптический микроскоп. Взвеси – системы мутные и непрозрачные. Взвеси неустойчивы, частицы диспергированного вещества выпадают в осадок (песок + вода), а если плотность диспергированного вещества меньше плотности среды, то диспергированное вещество всплывает (глина + масло). Процесс разделения взвесей называется седиментацией (для суспензий) и расслоением(для эмульсий).
II. Коллоидные системы – это такие дисперсные системы, в которых частицы распределённого вещества имеют размеры порядка 10 –9 – 10 –7 м. Каждая такая частица может содержать большое число атомов или молекул. Такие частицы невидимы через обычный микроскоп, но видимы в ультрамикроскоп, где свет падает сбоку или сзади, в результате чего в поле зрения видны светлые точки, возникающие в результате рассеяния света диспергированными частицами.
|
|
|
III. Истинные растворы или просто растворы – это дисперсные системы, в которых диспергированное вещество распределено в среде в виде молекул или ионов; частицы имеют размеры порядка 10 –10 – 10 –7 м. Растворы системы однородные, устойчивые.
Способы выражения концентрации растворов.
Способы выражения концентрации растворов.
I. ω - массовая доля (процентная) концентрация, показывает сколько грамм растворённого вещества содержится в 100 г раствора и выражается формулой:
 , где m (вещ-ва) – масса вещества,
, где m (вещ-ва) – масса вещества,
m (р-ра) – масса раствора, m (р-ра) = m (р-ля) + m (вещ-ва)
Пример: ω (С6Н12О6) = 10%. Это означает, что в 100 г раствора глюкозы содержится 10 г С6Н12О6 и 90 г Н2О.
II. CМ или М – молярная концентрация, показывает какое количество молей растворённого вещества содержится в одном литре раствора и выражается формулой:
 ,
,
где n (X) – количество молей растворённого вещ-ва, V – объём раствора в литрах.
Пример: 2М NaOH – двумолярный р-р NaOH. Это означает, что в 1 л данного раствора содержится 2 моля NaOH.
0,1М – децимолярный р-р, 0,01М – сантимолярный р-р, 0,001М – миллимолярный р-р.
III. СN или N, – нормальная (эквивалентная) концентрация показывает количество эквивалентов растворённого вещества в одном литре раствора и выражается формулой:  ,
,
где nэ (X) – количество эквивалентов в-ва (Х), V – объём раствора в литрах.
Пример: 0,1 N НС1 – децанормальный р-р НС1. это означает, что в 1 л данного раствора содержится 0,1 эквивалента НС1.
IV. T. t – титрованная концентрация (титр) показывает сколько грамм растворённого вещества содержится в одном мл раствора и выражается формулой:  ,
,
где m (в-ва) – масса вещества в г, V – объём р-ра в мл.
 ,
,
где N – нормальная концентрация, МЭ (Х) – моль-эквивалент вещества (частиц) Х.
Пример: Т (Н2SO4) = 0,05 г/мл. Это означает, что в 1 мл данного раствора содержится 0,05 г Н2SO4.
Химический эквивалент.
Эквивалентом вещества называется такое количество его, которое взаимодействует с одним молем атомов водорода или с одним эквивалентом любого другого вещества. Обозначается Э (Х) и выражается в молях.
|
|
|
Масса одного эквивалента вещества называется эквивалентной массой или моль-эквивалентом. Обозначается МЭ (Х) и выражается в г/моль.
Эквивалент в большинстве случаев – величина переменная и определяется для каждой реакции.
Способы расчета МЭ:
1). МЭ кислоты = 
H2SO4 + KOH = KHSO4 + H2O

H2SO4 + 2KOH = K2SO4 + 2H2O

2) МЭ основания = 
Са (ОН)2, МЭ Са(ОН)2 = 
3). МЭ соли = 
Al2(SO4)3, МЭ Al2(SO4)3 = 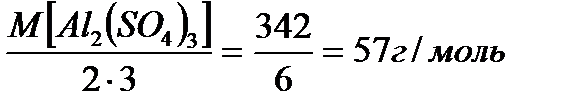
|
|
|


