 |
Конспект лекции № 3. Клеточный уровень жизни. Молекулярные основы воспроизводства клетки. Репликация ДНК. Биосинтез белка.
|
|
|
|
Репликация (удвоение, редупликация) ДНК требует 5 главных условий. Отсутствие любого из них делает воспроизводство живой клетки невозможным.
1. Наличие исходной матрицы – всей "старой" молекулы ДНК. Она определяет точную последовательность нуклеотидов. Без нее "новая" молекула будет бессмысленной. В цепочке ДНК тройка последовательных нуклеотидов (триплет) кодирует 1 аминокислоту или сигнал о прекращении синтеза (см. таблицу 1).
2. Наличие строительного материала. Строительным сырьем для ДНК являются отдельные дезоксирибонуклеотиды с азотистыми основаниями ДНК (аденин, гуанин, цитозин, тимин). В процессе их подготовки к синтезу нуклеотиды взаимодействуют с АТФ и превращаются в нуклеозидтрифосфаты (аденинтрифосфат, гуанинтрифосфат, цитозинтрифосфат и тиминтрифосфат), которые обладают собственной энергией для соединения в цепочки.
3. Наличие энергии. Энергия АТФ для синтеза новых цепочек ДНК опосредуется нуклеозидтрифосфатами (см. выше).
4. Наличие катализаторов реакций синтеза ферментов (ДНК-полимеразы, ДНК-лигазы и др.).
5. Наличие места для синтеза. Местом репликации ДНК является ядро эукариотической клетки или цитоплазма (прокариоты).
Отсутствие любого из данных условий делает процесс синтеза невозможным.
Последовательность событий при репликации ДНК.
Расхождение нитей двойной спирали. При этом, разрываются водородные связи между комплементарно спаренными азотистыми основаниями старых параллельных цепочек ДНК. Образуется сразу несколько репликационных точек.
Свободные дезоксирибонуклеотиды комплементарно спариваются с освободившимися на старых материнских цепочках нуклеотидами и соединяются в новые цепочки прочными ковалентными связями.
|
|
|
Этот процесс обеспечивают сложные ферментные комплексы в состав которых входит ДНК-полимераза, ДНК-лигаза и др.
Принцип комплементарного спаривания азотистых оснований нуклеотидов лежит в основе реализации генетической информации в процессе биосинтеза белка.
Главные условия для биосинтеза белка похожи на условия репликации ДНК.
1. Наличие исходной матрицы – участка молекулы ДНК- гена. Ген имеет строго определенную последовательность нуклеотидов, а значит определяет точную последовательность аминокислот в полипептидной цепочке собираемого белка.
2. Наличие строительного материала. Строительным сырьем для РНК являются отдельные рибонуклеотиды с азотистыми основаниями: аденин, гуанин, цитозин, урацил.
3. Наличие энергии АТФ.
4. Наличие ферментов (например, РНК-полимеразы).
5. Наличие места для синтеза. Местом первого этапа биосинтеза белка является ядро эукариотической клетки или цитоплазма (прокариоты), а второй этап протекает на рибосомах гранулярной эндоплазматической сети.
Последовательность событий при биосинтезе белка.
Условно выделяют главных 4 этапа этого процесса.
1. Транскрипция. Дословно "транскрипция" переводится, как "переписывание". Но это не вполне удачный термин. Переписывать пока некуда. На первом этапе происходит синтез и-РНК из «новых» свободных рибонуклеотидов. Точнее и грамотнее называть первый этап синтезом и-РНК. Смысл этого процесса — переписывание информации о структуре белка с огромного неподвижного носителя (ДНК в составе хромосомы) на небольшой подвижный носитель - м-РНК. Примерно так же обстоит дело, когда с жесткого диска компьютера, содержащего тысячи файлов, переписывают один из них на флешку. С той лишь разницей, что м-РНК в процессе записи информации образуется из новых нуклеотидов. Следовательно, м-РНК, считанные с разных генов, должны отличаться друг от друга — как отличаются друг от друга сами гены.
|
|
|
- Расхождение нитей двойной спирали ДНК, как испорченной застежки - молнии (рвутся "старые" водородные связи между комплементарно спаренными азотистыми основаниями параллельных цепочек). Формируется «репликационный глазок» - ДНК расщепляются не с конца молекулы, а с любого участка, при этом, впереди и позади разрыва по цепочке ДНК эти водородные связи сохраняются).
- Свободные «новые» рибонуклеотиды комплементарно спариваются с освободившимися на ДНК азотистыми основаниями «старых» нуклеотидов водородными связями.
- Ферментный комплекс РНК-полимеразы сшивает рибонуклеотиды ("наживленные" водородными связями) в цепочку и-РНК прочными ковалентными связями.
- Новая и-РНК отходит от участка ДНК (цепочки ДНК восстанавливают "старые" водородные связи).
Непосредственный продукт транскрипции гена правильней называть предшественником м-РНК (пре-м-РНК). Дело в том, что новообразованная м-РНК подвергается, тут же (в ядре) созреванию, или процессингу. При этом она претерпевает существенную модификацию. И лишь после того зрелая м-РНК (видимо, в комплексе со специальными белками) поступает из ядра в цитоплазму.
2. Процессинг В результате процессинга из и-РНК вырезаются "технологические" участки нуклеотидов, не содержащие информацию о строении синтезируемого белка (интроны). Далее происходит сшивание (сплайсинг), оставшихся после вырезания участков и-РНК, содержащих информацию о синтезируемом белке (экзонов) и превращается в зрелую м-РНК.
Рисунок 1. Матричный синтез белка.
 3. Трансляция. Трансляция - процесс сборки молекул белка из аминокислот по программе, диктуемой зрелой м-РНК. Это перевод информации с "языка" нуклеиновых кислот на "язык" белков. Суть этой программы - определение очередности, в которой аминокислоты должны включаться в строящуюся белковую (пептидную) цепь. Причем в процессе участвуют не свободные, а активированные аминокислоты: каждая из них связана с т. н. транспортной РНК (т-РНК), т. е. находится в виде аминоацил-т РНК (аа-т РНК). Для каждой из 20 аминокислот имеется своя специфическая форма т-РНК, а чаще — даже не одна, а несколько форм. К рибосомам с помощью т-РНК транспортируются аминокислоты, фиксированные на "черешке клеверного листа" т-РНК.
3. Трансляция. Трансляция - процесс сборки молекул белка из аминокислот по программе, диктуемой зрелой м-РНК. Это перевод информации с "языка" нуклеиновых кислот на "язык" белков. Суть этой программы - определение очередности, в которой аминокислоты должны включаться в строящуюся белковую (пептидную) цепь. Причем в процессе участвуют не свободные, а активированные аминокислоты: каждая из них связана с т. н. транспортной РНК (т-РНК), т. е. находится в виде аминоацил-т РНК (аа-т РНК). Для каждой из 20 аминокислот имеется своя специфическая форма т-РНК, а чаще — даже не одна, а несколько форм. К рибосомам с помощью т-РНК транспортируются аминокислоты, фиксированные на "черешке клеверного листа" т-РНК.
|
|
|
- Антикодоны т-РНК комплементарно взаимодействуют с триплетными кодонами и-РНК и образуют водородные связи.
- В начале процесса трансляции с рибосомальным активным центром связывается инициирующая и-РНК. У эукариот инициирующий кодон всех и-РНК всегда кодирует аминокислоту метионин (стартовый кодон АУГ).
- Две соседние молекулы т-РНК, связавшиеся на рибосоме с и-РНК, создают условия для образования пептидной связи между аминокислотами, фиксированными на их "черешках".
- После образования пептидной связи первая т-РНК, "отпускает" свою аминокислоту, а сама разрывает водородные связи и уходит с рибосомы в цитоплазму на "охоту" за новой аминокислотой. Вторая т-РНК (с двумя аминокислотами), спаренная с и-РНК, смещается на место первой в рибосоме.
- Следующая т-РНК с третьей аминокислотой образует комплементарные водородные связи с третьим кодоном и-РНК, создавая условия для пептидной связи между второй и третьей аминокислотой, процесс повторяется, и полипептидная цепочка растет.
- Рост белковой цепочки продолжается до терминирующего стоп-кодона и-РНК, после которого новый белок покидает рибосому.
Рибосомы играют в трансляции роль молекулярных машин, обеспечивающих правильное взаимодействие участников. В состав рибосомы входят четыре молекулы т. н. рибосомной РНК (р-РНК) — по одной молекуле каждого из 4-х видов р-РНК. Объединяясь с рибосомными белками, они образуют две субъединицы рибосомы и выполняют в них структурную, а также, возможно, каталитическую функции.
Таким образом, в трансляции участвуют РНК трех классов — м-РНК, т-РНК и р-РНК.
- Молекула и-РНК связывается сразу с несколькими рибосомами, формируя полирибосому. Это позволяет синтезировать одновременно несколько одинаковых молекул белка.
После окончания трансляции новый белок обычно не работает. Он должен приобрести рабочую (третичную или четвертичную) структуру. Этот процесс называется фолдинг (рис. 2).
|
|
|
4. Фолдинг. После трансляции первичные структуры новых молекул белка связываются с особыми ферментативными комплексами - шаперонами или фолдазами. В них происходит преобразование пространственного (трехмерного) строения новых белков. Этот процесс окончательного формирования рабочих структур называется фолдинг.
Рисунок 2. Схема фолдинга.
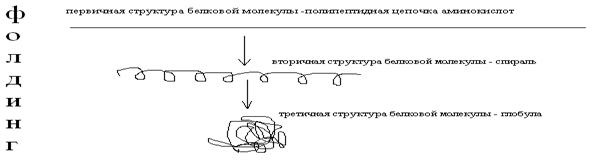
Таким образом, как видим, фолдинг - очень важный этап в образовании работоспособных белков.
Затем было обнаружено, что данные факторы можно разделить на две группы.
Как и прочие ферменты, они требуются лишь в каталитических количествах, т. е. в концентрациях, на порядки меньших, чем у «обслуживаемых» ими белков.
Шапероны могут обеспечить белку удобное место для безопасного сворачивания в третичную структуру – «котел с крышкой».
Показательно в связи с этим исходное значение слова «шаперон» в английском языке: это пожилая дама, сопровождающая молодую девушку на балах.
Аналогично и молекулярные шапероны: способствуя правильному фолдингу, они как бы впервые выводят в свет «молодые» белки.
Из предыдущего изложения можно представить, что фолдинг - особенно с участием фолдаз и шаперонов - всегда приводит полипептидную цепь к «правильной», наиболее оптимальной в энергетическом и функциональном отношениях, структуре.
К сожалению, это не так. Существует группа тяжелых неврологических болезней, которые обусловлены закономерно повторяющимся «неправильным» фолдингом одного, вполне определенного белка.
Данный белок, если он находится в нормальной конформации, называется прионовым белком. Обнаруживается он в мозгу; функция его неизвестна.
При ряде же заболеваний тот же полипептид оказывается в другой конформации. В последней преобладают участки с бета-структурой, почти отсутствующие в нормальной нативной форме, а молекулы белка имеют повышенную склонность к агрегации. Такой белок называется прионом (от proteinaceous infection particle - белковая инфекционная частица). В данной форме он, видимо, не способен к выполнению своей обычной функции.
Но самое худшее заключается в том, что «неправильная» форма белка вызывает переход в такую же форму и «правильных» форм. Как это происходит, неясно. Возможно, имеет место захват «правильных» молекул агрегатами приона, в результате чего эти молекулы разворачиваются и организуются заново, но по подобию прионов.
Таким образом, прионы в отношении своих исходных молекул играют роль антишаперонов, осуществляющих как бы фолдинг наоборот. Более того, процесс, очевидно, является автокаталитическим: вновь образовавшиеся порции «испорченного» белка начинают «портить» очередные порции нативного белка. Процесс продолжается, пока весь белок не оказывается «испорчен». Болезнь развивается в течение нескольких лет, но неотвратимо приводит к гибели животного или человека.
|
|
|
Как возникают в организме первые порции приона? Иногда, чрезвычайно редко, это происходит спонтанно - в результате ошибки фолдинга. Несколько чаще встречаются мутации, тогда болезнь передается по наследству. Наиболее часто болезнь возникает в результате употребления в пищу тех тканей животного, в которых содержатся прионы. Потому-то данные белки и названы инфекционными частицами.
Их отличает еще одна очень важная особенность - устойчивость к протеазам. Это помогает прионам проникать в неизмененном виде из желудочно-кишечного тракта в нервную ткань, где и запускается вышеизложенный автокаталитический процесс.
Все вместе это делает прионы уникальным инфекционным агентом: это, видимо, единственный случай, когда подобный агент лишен нуклеиновой кислоты (белковая инфекция).
Как же называются вызываемые прионами болезни? У коров это т. н. губчатая энцефалопатия (BSE - bovine spongiform encephalopathy), или коровье бешенство. Употребление человеком мяса таких коров вызывает болезнь Крейнцфельда-Якоба. Использование в популярной литературе термина «вирус коровьего бешенства» неграмотно. Прионы не вирусы. Кроме того, среди туземцев Новой Гвинеи известна еще одна болезнь той же природы - куру, при которой на лице человека то и дело появляются гримасы, как при смехе. Считают, что куру передается в результате каннибализма. Наконец, у овец болезнь называется почесухой: постоянный зуд заставляет животных все время тереться о твердые предметы. Открытие прионовых болезней позволяет некоторым биологам усомнится в так называемой «центральной догме молекулярной биологии». Определяющей однонаправленность потока информации от нуклеиновых кислот к белкам (ДНК↔РНК→белок).
Многоклеточный организм человека возникает при слиянии сперматозоида и яйца в единственную клетку – зиготу, содержащую 46 хромосом. Затем из зиготы, путем митотического деления, вырастает полноценный организм из огромного числа разнообразных клеток. В ядре каждой их этих десятков триллионов клеток есть все те же 46 хромосом (46 молекул нуклеопротеидов). При этом последовательность нуклеотидов в ДНК ядра зиготы и ДНК ядра любой клетки (печени, кожи, мозга) одинаковы. Но тогда возникает вопрос, почему клетки нашего организма не похожи друг на друга и почему они выполняют разные функции.
Серьезный шаг по решению этой научной проблемы был сделан Жакобом и Моно. Они выдвинули гипотезу о том, что у бактерий гены работают в клетке не одновременно. Большую часть времени большая часть генов выключена "отдыхает", небольшая часть генов включена "работает". Главный механизм включения и выключения генов Жакоб и Моно связали с понятием о генах-операторах, белках репрессорах и индукторах.
По гипотезе Жакоба-Моно, перед обычным структурным геном находится ген-оператор, обеспечивающий фиксацию фермента РНК-полимеразы (участок для непосредственного присоединения РНК-полимеразы называется промотор) и начало транскрипции. Обычно, с геном-оператором связан белок-репрессор и в таком состоянии фермент РНК-полимераза не может связаться с геном оператором и начать считывать информацию структурных генов ДНК (рис. 3).
Рисунок 3. Выключенное (исходное) состояние структурных генов.
ген-оператор структурные гены
───────────────|───────────────────────
───┬═══════════|───────────────────────
└───────────┘ - белок-репрессор
│ │ │
╚════════╩═╝ - РНК-полимераза
Чтобы начать процесс считывания информации (транскрипцию), надо освободить ген-оператор от белка-репрессора. Роль "освободителя" берет на себя молекула-индуктор (дерепрессор). Индуктор связывается с белком-репрессором и отрывает его от гена-оператора (рис. 4 а и 4 б).
Рисунок 4 а. Связывание индуктора с белком-репрессором.
ген-оператор структурные гены
───────────────|───────────────────────
───┬═══════════|───────────────────────
╞═══════════╡ - белок-репрессор
└───────────┘ - индуктор
│ │ │
╚════════╩═╝ - РНК-полимераза
Рисунок 4 б. Освобождение гена-оператора от белка-репрессора (дерепрессия).
ген-оператор структурные гены
───────────────|───────────────────────
───────────────|───────────────────────
┌───────────┐ - белок-репрессор
╞═══════════╡
└───────────┘ - индуктор
│ │ │
╚════════╩═╝ - РНК-полимераза
Теперь ген-оператор свободен и к нему прикрепляется фермент РНК-полимераза, начиная транскрипцию – синтез м-РНК. Структурные гены включаются, и начинается транскрипция и трансляция (рис. 5).
Рисунок 5. Структурные гены включены, идет биосинтез белка.
ген-оператор структурные гены
───────────────|──────────────────────
─────┬────────┬|┬─────────────────────
╚════════╩═╝ ~~~~~~~~~~~~~~~~~~~~ - м-РНК (транскрипция)
РНК-полимераза
~~~~~~~~~~~~~~~~ - и-РНК (процессинг)
┬┬┬┬┬┬┬┬┬┬┬┬┬┬┬┬┐ - белок-продукт
┴┴┴┴┴┴┴┴┴┴┴┴┴┴┴┴┘ (трансляция)
При накоплении достаточного количества белка-продукта происходит реакция его взаимодействия с комплексом индуктор – белок-репрессор. При этом молекулы индуктора разрушаются. Белок-репрессор освобождается (рис. 6).
Рисунок 6. Разрушение молекулы индуктора и освобождение белка-репрессора.
Белок-репрессор
┌───────────┐
╞═══════════╡ ┬┬┬┬┬┬┬┬┬┬┬┬┬┬┬┬┐ - белок-продукт
└───────────┘ ┴┴┴┴┴┴┴┴┴┴┴┴┴┴┴┴┘
индуктор
Белок-репрессор
┌───────────┐
└───────────┘ ┬┬┬┬┬┬┬┬┬┬┬┬┬┬┬┬┐ - белок-продукт-терминатор индуктора
┴┴┴┴┴┴┴┴┴┴┴┴┴┴┴┴┘
┌──┐┌───────┐
└──┘└───────┘ -распад индуктора
В заключении освобожденный белок-репрессор вытесняет РНК-полимеразу со своего "законного" места и закрывает подход к структурным генам. Тем самым, процесс биосинтеза белка прекращается – структурные гены выключаются – переходят в исходное состояние (рис. 7).
Рисунок 7. Выключенное (исходное) состояние структурных генов
ген-оператор структурные гены
───────────────|───────────────────────
───┬═══════════|───────────────────────
└───────────┘ - белок-репрессор
│ │ │
╚════════╩═╝ - РНК-полимераза
Гипотеза Жакоба-Моно была обоснована результатами исследования культуры кишечной палочки, жившей на питательной среде с глюкозой. При пересадке ее на питательную среду с лактозой скорость роста колонии снижалась, но затем восстанавливалась после включения гена, ответственного за синтез ферментов, расщепляющих лактозу. В этом случае, индуктором была сама лактоза, а реактиватором белка-репрессора был белок-продукт (фермент для расщепления лактозы).
У более сложных эукариотов и многоклеточных организмов включение и выключение генов может опосредоваться несколькими промежуточными веществами и медиаторами нервной системы. Тем не менее, общая схема регуляции активности генов остается подобной той, что описана у Жакоба и Моно.
Открытие системы белков-репрессоров, контролирующих большую часть структурных генов, и принципиальная возможность их дерепрессии открывает перед медицинской генетикой фантастические перспективы. Если научиться избирательно включать и выключать определенные гены, то можно, например, восстанавливать у больных людей любые органы и даже ампутированные конечности.
Нарушение правильной последовательности отдельных нуклеотидов в молекуле ДНК или РНК называют точковыми мутациями. Они возникают при действии мутагенных факторов: физических (ионизирующая радиация), химических (лекарства), биологических (вирусы).
Возможны 4 типа точковых мутаций.
1. Замещение. Место одного нуклеотида заменяет другой.
…ААА ТТТ ЦАЦ ЦГА ГГГ... - норма
…ААТ ТТТ ЦАЦ ЦГА ГГГ... - мутация
Последствия замещения (для собираемой белковой молекулы):
а - возникновение стоп-кодона и прекращение сборки белка
(УГЦ-Цис УГА-стоп)
б - замена одной аминокислоты (ААЦ-Асн ААА-Лиз)
в - сборка нормального белка, если замещение попало на вырожденный код (ААА-Лиз ААГ-Лиз)
г – исчезновение стоп-кодона и продолжение синтеза бессмысленного полипептида.
2. Инверсия (вращение). Соседние нуклеотиды меняются местами
…ААА ТТТ ЦАЦ ЦГА ГГГ... - норма
…ААТ АТТ ЦАЦ ЦГА ГГГ... - мутация
Последствия инверсии (для собираемой белковой молекулы):
а - возникновение стоп-кодона и прекращение сборки белка
(УАЦ ААА-Тир Лиз УАА ЦАА-стоп Глн)
б - замена двух аминокислот (ААА ЦЦЦ-Лиз Про ААЦ АЦЦ-Асн Тре)
в - замена одной аминокислоты, если инверсия между соседними триплетами у одного из них попала на вырожденный код
(ААА ГГГ-Лиз Гли ААГ АГГ-Лиз Арг)
г – исчезновение стоп-кодона и продолжение синтеза бессмысленного полипептида.
д - сборка нормального белка, если инверсия между соседними триплетами обоих нуклеотидов попала на вырожденный код
(ЦЦЦ АГГ-Про Арг ЦЦА ЦГГ-Про Арг)
3. Вставка. В последовательность нуклеотидов вставляется новый лишний нуклеотид
…ААА ТТТ ЦАЦ ЦГА ГГГ... - норма
…ААА ЦТТ ТЦА ЦЦГ АГГ Г... - мутация
Последствия вставки (для собираемой белковой молекулы):
а - возникновение стоп-кодона и прекращение сборки белка (УАЦ ААА-Тир Лиз УАА ЦАА А стоп-Глн)
б – исчезновение стоп-кодона и продолжение синтеза бессмысленного полипептида.
в - сдвиг рамки триплетного кода и сборка бессмысленного белка
...ААА УУУ ЦАЦ ЦГА ГГГ...- Лиз Фен Гис Арг Гли…
...ААА ЦУУ УЦА ЦЦГ АГГ Г...- Лиз Лей Сер Про Арг…
4. Выпадение (делеция). Из последовательности нуклеотидов теряется нормальный нуклеотид
...АААТТТЦАЦЦГАГГГА... - норма
...ААТТТЦАЦЦГАГГГА... - мутация
Последствия вставки (для собираемой белковой молекулы):
а - возникновение стоп-кодона и прекращение сборки белка (УАЦ ААА-Тир Лиз УАА АА- стоп-)
б – исчезновение стоп-кодона и продолжение синтеза бессмысленного полипептида.
в - сдвиг рамки триплетного кода и сборка бессмысленного
...ААА УУУ ЦАЦ ЦГА ГГГ...- Лиз Фен Гис Арг Гли…
...ААА УУЦ АЦЦ ГАГ ГГ...- Лиз Фен Тре Глу…
Для реального организма любая мутация, ведущая к нарушению последовательности нуклеотидов, может иметь 3 физиологических последствия:
1 - смерть;
2 - болезнь, но возможно она проявится через несколько поколений;
3 - нет заметных изменений здоровья, если изменилась часть белка, не имеющая важного функционального значения.
|
|
|


