 |
После перенесенного стресса
|
|
|
|
| Вариант опытов | Амплитуда сокращения, % исходной длины | Скорость сокращения, м. е./с | Скорость расслабления, м. е./с |
| Контроль (18) | 4,96+0,40 | 0,64±0,04 | 0,53±0,04 |
| Стресс (10) | 2,14+0,29* | 0,24±0,01* | 0,18+0,01* |
| Адаптация (19) | 5,35±0,46 | 0,66±0,05 | 0,65±0,05 |
| Адаптация + + стресс (14) | 5,54±0,31** | 0,70±0,02** | 0,66±0,02** |
| Примечание. Цифра в скобках — число животных; м. е. — мышечная единица; частота сокращений мышцы 20 в минуту. * Отличия от варианта «контроль» достоверны. ** Отличия от варианта «стресс» достоверны. |
| Рис. 2.Инотропный ответ изолированной папиллярной мышцы у крыс на изменение концентрации Са2+. К — контроль. А — адаптация к физической нагрузке. 1 — дефицит Са2+ 1,25 мМ; 2 — избыток Са2+ 7,50 мМ. Ордината — величины показателей сократительной функции, %; за 100% приняты величины показателей при оптимальной концентрации Са2+ (2,50 мМ). Ас — амплитуда сокращения; Сс — скорость сокращения; Ср — скорость расслабления. Светлые столбики — без стресса; заштрихованные — стресс. | 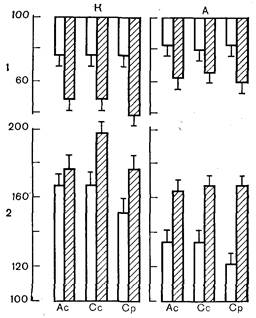
|
условиях ее сокращения: величины этих показателей у адаптированных животных не отличались от контроля. Однако адаптация полностью предупредила депрессию сократительной функции миокарда, вызванную стрессом. Как следует из табл. 2, у животных, предварительно адаптированных к физической нагрузке, все основные показатели сократительной функции папиллярной мышцы не отличались от контрольных значений.
Далее выяснилось, что депрессия сократительной функции сердечной мышцы сочетается у перенесших стресс животных с повышением ее чувствительности к изменению внеклеточной концентрации ионов Са2+, а также естественных антагонистов этого катиона — ионов Na+ и Н+, которые, как известно, конкурируют с Са2+ за ^пункты связывания в структурах сарколеммы кардиомиоцитов и способны при увеличении концентрации вытеснять его из этих пунктов и вызывать тем самым снижение сократительной способности сердечной мышцы [Tillisch J., Langer G., 1974; Poole-Wilson P., 1980]. Выяснилось, что перенесенный стресс снижает способность мембранного аппарата кардиомиоцитов связывать и транспортировать Са2+. Было показано, что предварительная адаптация к физической нагрузке в значительной мере ограничивает и предупреждает данные эффекты стресса. Это положение демонстрируют рис. 2 и 3. На рис. 2 представлены данные о влиянии перенесенного стресса на чувствительность изолированной папиллярной мышцы к дефициту и избытку ионов Са2+ в омывающем растворе Кребса — Хензелейта у контрольных и адаптированных животных.
|
|
|
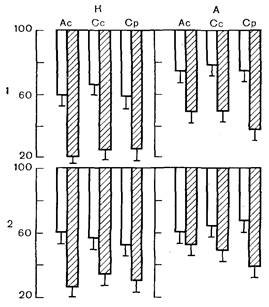
| Рис. 3. Инотропный ответ изолированной папиллярной мышцы крыс на изменение концентрации ионов Na+ и Н+. К — контроль; А — адаптация к физической нагрузке. 1 — увеличение концентрации ионов Na+ до 165 мМ; 2 — снижение рН до 6,85 (увеличение ионов Н+). Ордината — величины показателей сократительной функции, %; за 100% приняты величины показателей при оптимальной концентрации ионов. Остальные обозначения, как на рис. 2. |
Эти данные показывают, что у неадаптированных животных стресс увеличивает депрессию показателей сократительной функции миокарда, возникающую в ответ на уменьшение концентрации Са2+; отрицательный инотропный эффект дефицита Са2+ увеличивается у них под влиянием стресса более чем в 2 раза (см. 1 на рис. 2).
Предварительная адаптация, как видно из рис. 2, А, не только уменьшает отрицательный инотропный эффект дефицита Са2+, но и существенно ограничивает его стрессорную потенциацию (см. 1 на рис. 2). Аналогичные данные были получены при действии избытка Са2+. Как показывает рис. 2, стресс в значительной мере увеличивает обычно возникающий в ответ на повышение концентрации Са2+ в растворе положительный инотропный эффект. Предварительная адаптация к физической нагрузке не только весьма заметно ограничивает вызванный избытком Са2+ прирост сократительной функции миокарда, но существенно предупреждает потенциацию этого эффекта, обусловленную перенесенным стрессом. Таким образом, предварительная адаптация снижает чувствительность миокарда к нарушениям содержания Са2+ и предупреждает стрессорное повышение этой чувствительности. Далее на рис. 3 приведены результаты изучения влияния предварительной адаптации к физической нагрузке на реакцию [миокарда на избыток антагонистов Са2+ — ионов Na+ и Н+ после перенесенного стресса. Эти данные показывают, что увеличение концентрации Н+ (снижение рН раствора с 7,4 до 6,85) или концентрации ионов Na+ (увеличение концентрации хлористого натрия до 165 мМ) в омывающем папиллярную мышцу растворе Кребса — Хензелейта приводит у
|
|
|
животных всех групп к характерному уменьшению показателей сократительной функции миокарда—отрицательному инотропному эффекту, связанному с конкурентным вытеснением этими катионами Cа2+. Стресс в значительной мере потенцирует этот эффект: депрессия показателей сократительной функции миокарда, вызванная избытком ионов Na+ или Н+, как видно на рис. 3, у перенесших стресс животных возрастает примерно вдвое по сравнению с контролем. Предварительная адаптация существенно предупреждает данную стрессорную потенциацию чувствительности миокарда к катионным сдвигам.
При оценке результатов этих исследований следует подчеркнуть, что используемые катионные пробы, выявляющие способность мембранного аппарата кардиомиоцитов связывать и транспортировать Са2+, в определенной степени имитируют нарушения катионного обмена в миокарде, характерные как для максимальных физических нагрузок, при которых они лимитируют увеличение функции сердца [Калинин В. М., 1981; Adams R., Welch H., 1980], так и для сердечно-сосудистых заболеваний [Меерсон Ф. З., Уголев А. А., 1980; Капелвко В. И., 1981; Poole-Wilson P., 1980]. В частности, экспериментально создаваемый избыток Н+ и снижение рН во внеклеточном пространстве имитируют сопутствующий многим заболеваниям (и в том числе ишемическим повреждениям сердца) метаболический ацидоз, при котором возникающий в крови избыток НСО3 и Н+ сопровождается проникновением их через мембраны в клетки [Poole-Wilson P., 1980].
|
|
|
Таким образом, полученные данные позволяют полагать, что адаптация к физическим нагрузкам может играть важную роль как средство предупреждения нарушений сократительной функции сердца, связанных с катионными сдвигами в миокарде при сердечно-сосудистых заболеваниях и как средство профилактики потенциации этих нарушений при стрессе.
При анализе механизмов продемонстрированного в приведенных исследованиях профилактического перекрестного эффекта следует иметь ввиду, что при стрессорном воздействии, как будет подробно рассмотрено в 3-й и последующих главах, интенсивное и длительное влияние на сердце катехоламинов приводит к избыточной активации свободнорадикального окисления и в том числе перекисного окисления липидов, продукты которого повреждают мембраны кардиомиоцитов и клеток проводящей системы сердца. Это приводит к нарушению механизмов, ответственных за энергообеспечение кардиомиоцитов и ионный транспорт. Так, в частности, возникающие при этом повреждения липидного бислоя мембран кардиомиоцитов и потеря гликокаликсом сиаловой кислоты [Меерсон Ф. 3., Сауля А. И., Гудумак В. С., 1985] приводят к увеличению проницаемости мембран для Са2+, снижению содержания Са2+ в фосфолипидных участках его связывания в сарколемме, нарушению способности мембран связывать Са2+ и в целом — к нарушению транспорта этого катиона в кардиомиоцитах и дестабилизации кальциевого гомеостаза сердечной мышцы.
Эти изменения в совокупности (вызывают нарушение процессов возбуждения, сокращения и расслабления кардиомиоцитов и, как следствие — депрессию амплитуды и скорости сокращения и расслабления миокарда, что было продемонстрировано в экспериментах иа целом сердце и на изолированной сердечной мышце крыс при эмоционально-болевом стрессе.
В связи с этим можно предположить, что профилактический антистрессорный эффект адаптации к физической нагрузке обусловлен прежде всего предупреждением стрессорной активации свободнорадикального окисления липидов. За счет чего может реализоваться ограничение этой активации в адаптированном: организме? Во-первых, за счет того, что в таком организме, как рассмотрено в 1-й главе, стресс-реакция, возникающая в ответ на воздействие факторов среды, выражена в значительно меньшей степени, чем в нетренированном. В соответствии с этим в тренированном организме при стрессе существенно уменьшен «выброс» катехоламинов в кровь в исполнительных органах и в том числе — в сердце и, как следствие, — ограничено их активирующее влияние на процессы свободнорадикального окисления.
|
|
|
Во-вторых, в адаптированном организме оказывается увеличенной мощность антиоксидантных ферментных систем, что также может ограничивать активацию перекисного окисления липидов при стрессе.
Действительно, как уже было показано в 1-й главе, в процессе адаптации к нагрузкам на выносливость, к которым относится и плавание, использованное в обсуждаемых исследованиях, повышается активность антиоксидантных ферментов в скелетных мышцах [Higuichi M. et al., 1983; Quantanilha А. Т., 1984], что сопровождается менее выраженной, чем у нетренированных животных, активацией в них свободнорадикального окисления, возникающей при максимальных физических нагрузках [Jenkins R. et al., 1983]. Сходные отношения наблюдаются у тренированных животных и в миокарде; причем повышение активности в нем антиоксидантных ферментов сопровождается отсутствием у этих животных повреждений мембран кардиомиоцитов и ферментемии, закономерно возникающих при максимальных физических нагрузках у неадаптированных животных [Quantanilha A., 1984].
Таким образом, существенную роль в рассматриваемом профилактическом эффекте тренированности при стрессорных воздействиях наряду с уменьшением выраженности стресс-реакции играет развивающееся в процессе адаптации увеличение функциональных возможностей стресс-лимитирующей антиоскидантной системы в миокарде.
Как было показано выше, стресс повышает зависимость кардиомиоцитов от изменений концентрации Са2+ во внеклеточной среде и чувствительность к действию конкурентов Са2+ за пункты связывания иа мембранах, т. е. стресс снижает способность мембранных механизмов связывать и транспортировать Са2+. Поскольку эти явления непосредственно связаны с состоянием мембранных механизмов, ответственных за перенос и связывание Са2+, то можно полагать, что защитный эффект адаптации обусловлен какими-то
определенными изменениями, возникающими в процессе тренированности в липидном бислое или гликокаликсе сарколеммы и мембранах СПР кардиомиоцита, которые повышают мощность механизмов связывания транспорта Са2+.
|
|
|
Как уже отмечалось в 1-й главе, важным компонентом структурного «следа» устойчивой адаптации к физическим нагрузкам является увеличение в миокарде мощности механизма транспорта Са2+ в мембранах СПР [Penpargkul S. et al., 1977; Sordahl L. et al., 1977], связанное с ростом поверхности продольных канальцев СПР и объема аппарата Гольджи [Guski H. et al., 1981]. Показано далее, что адаптация приводит также к изменению фосфолипидного состава сарколеммы: увеличению в ней на 50% содержания фосфатидилсерина, играющего важную роль в связывании Са2+ [Tibbits G. F. et al., 1981 b]. Эти структурные изменения сопровождаются у адаптированных животных повышением резистентности сердечной мышцы к лантану, который обладает способностью вытеснять Са2+ из пунктов связывания в сарколемме, а также увеличением на 63% количества связывающих Са2+ участков в миокарде [Tibbits G. et al., 1981 а].
Уменьшение чувствительности миокарда адаптированных к физической нагрузке животных к колебаниям концентрации Са2+ во внеклеточном пространстве может быть связано также с увеличенным содержанием у них этого катиона в сарколемме кардиомиоцитов по сравнению с неадаптированными животными. В пользу этого положения свидетельствуют данные исследований D. Bers, К. Phillipson, G. Langer (1981) о том, что реакция изолированного миокарда на недостаток Са2+ в омывающей среде коррелирует с исходным содержанием Са2+ в сарколемме, а также только что рассмотренные данные об увеличенной способности миокарда тренированных животных связывать Са2+.
Следует отметить, что в сарколемме кардиомиоцитов у тренированных животных содержание линоленовой кислоты и полиненасыщенных жирных кислот больше, чем у нетренированных [Tibbits G. et al., 1978, 1981 а]. Это обстоятельство также может значительно ограничивать у адаптированных животных повреждающее действие активации перекисного окисления липидов в миокарде при стрессе.
При анализе механизмов профилактического защитного действия адаптации к физическим нагрузкам при стрессорных поражениях сердца следует учитывать также, что перенесенный стресс существенно нарушает адаптивные функции коронарного кровообращения.
Показано, что у перенесших иммобилизационный стресс крыс на 30% уменьшен коронарный резерв и значительно снижена авторегуляторная адаптивная реакция коронарных сосудов на ишемию [Солодков А. П., Сухорукова Т. А., 1985]. Это явление может быть связано с непосредственным повреждающим действием продуктов стрессорной активации перекисного окисления липидов на миоциты коронарных сосудов, которое приводит к нарушению сократительной функции сосудов, их хеморецепции и как следствие — к нарушению саморегуляции. Возможны также и другие механизмы этого явления.
В данном контексте мы хотим подчеркнуть, что коль скоро адаптация к физическим нагрузкам способна предупреждать или ограничивать стресс-реакцию и, следовательно, ее повреждающие эффекты, то правомерно полагать, что такая адаптация может
предупреждать также стрессорные повреждения коронарного русла и нарушение его адаптивной реакции на ишемию. Данное положение особенно важно для понимания защитных эффектов адаптации при острой ишемии и инфаркте миокарда.
Резюмируя изложенное, можно заключить, что в основе перекрестного профилактического эффекта адаптации к физическим нагрузкам при нарушениях сократительной функции сердца, вызванных стрессорным воздействием, лежат определенные компоненты разветвленного структурного «следа» данной адаптации. Это прежде всего адаптационная перестройка центральных и периферических регуляторных механизмов, приводящая к более экономному функционированию при экстремальных воздействиях стресс-реализующей адренергической системы и как следствие — к ограничению стресс-реакции. Эта перестройка приводит, как было показано в 1-й главе, и к увеличению активности системы опиоидных пептидов, важной стресе-лимитирующей системы, что также способствует ограничению стресс-реакции у адаптированных людей и животных (механизм этого действия опиоидных пептидов рассмотрен в 4-й главе). Во-вторых, это повышение мощности антиоксидантной системы в миокарде, которая ингибирует перекисное окисление липидов и, следовательно, ограничивает активацию этого процесса и повреждающее действие его продуктов на кардиомиоциты. В-третьих, это структурные изменения, формирующиеся в процессе адаптации на уровне мембран кардиомиоцитов, которые приводят к увеличению мощности механизмов, ответственных за связывание и транспорт Са2+, повышению резистентности мембран к ионным нагрузкам и повреждающему действию продуктов активации перекисного окисления липидов (ПОЛ).
Таким образом, рассмотренные исследования свидетельствуют, что адаптация к физическим нагрузкам является важным фактором предупреждения или ограничения стресеорных повреждений сердца. Этот перекрестный эффект адаптации имеет большое значение для превентивной медицины, поскольку стрессорный компонент занимает важное место в патогенезе ряда заболеваний человека.
Продолжим рассмотрение положительных перекрестных эффектов адаптации к физическим нагрузкам, стараясь выявить их механизмы и структурную основу, что будет способствовать обоснованному и целесообразному использованию этого мощного фактора воздействия на организм человека с целью профилактики и лечения сердечно-сосудистых заболеваний.
Профилактическое действие тренированности при сердечно-сосудистых заболеваниях характеризуется двумя основными особенностями: 1) предварительная адаптация организма к физическим нагрузкам может способствовать более легкому течению возникшей болезни, например уже «свершившегося» инфаркта миокарда или острой транзиторной ишемии, и более быстрому выздоровлению; 2) тренированность является фактором, предупреждающим само возникновение заболевания, что статистически выражается
более низкой заболеваемостью сердечно-сосудистыми и другими заболеваниями среди лиц, тренированных к физическим нагрузкам. Эти особенности адаптации связаны в значительной степени с уменьшением вероятности у тренированных людей развития факторов риска, что в свою очередь определяется наличием у них соответствующих компонентов структурного «следа» адаптации.
|
|
|


