 |
Внутренняя энергия реального года.
|
|
|
|
Внутренняя энергия газа Ван-дер-Ваальса имеет вид:
 . (12)
. (12)
Посмотрим, как можно получить это выражение. Полная внутренняя энергия идеального газа не зависит от объема, а зависит только от температуры.
Уравнение Гельмгольца имеет вид:
 . (13)
. (13)
Это уравнение позволяет определить изменение энергии при изменении объема, если известно уравнение состояния.
Внутренняя энергия реального газа зависит от температуры, объема и числа молей.
Проинтегрировав уравнение Гельмгольца по объему, получим
 .
.
При определенной массе газа, если неограниченно увеличивать объем, то плотность газа стремится к нулю и внутренняя энергия будет равна энергии идеального газа.
Из уравнения Ван-дер-Ваальса получим
 .
.
Подставив это выражение в (12), и вычислив интеграл получим выражение для внутренней энергии реального (модель Ван-дер-Ваальса) газа (12).
Насыщенный пар и влажность.
Насыщенный пар находится в динамическом равновесии с жидкостью, это означает, что число молекул, покинувших жидкость за некоторый промежуток времени, равно числу молекул, возвратившихся в жидкость за тот же промежуток времени.
Давление насыщенного пара – табличная величина, так как давление зависит только от температуры.
Насыщенный пар не подчиняется газовым законам, но для связи параметров можно использовать уравнение Менделеева-Клапейрона.
Плотность насыщенного пара, согласно этому уравнению связана с давлением следующей формулой:
 .
.
При постоянной температуре мы видим, что плотность прямо пропорциональна давлению.
Одной из важных характеристик воздуха является влажность.
Воздух представляет собой смесь сухого воздуха и пара.
Согласно закону Дальтона
|
|
|
 .
.
Плотность пара  в воздухе называется абсолютной влажностью.
в воздухе называется абсолютной влажностью.
Относительная влажность определяется отношением парциального давления пара к давлению насыщенного пара при той же температуре.
 %.
%.
Давление насыщенного пара увеличивается при увеличении температуры.
Поэтому, если температура уменьшается, относительная влажность увеличивается. Когда пар становится насыщенным (относительная влажность 100%), дальнейшее уменьшение температуры приводит к выпадению росы.
Температура, при которой пар становится насыщенным, называется точкой росы.
Энтальпия.
Одним из важных вопросов при изучении химических реакций был вопрос о том, сколько теплоты выделяется или наоборот поглощается при той или иной реакции, то есть вопрос о взаимосвязи реакции и теплоты. Раньше мы говорили о связи механической работы и теплоты.
Русский химик Герман Иванович Гесс провел серию опытов по нейтрализации кислот, после которых был сделан очень важный вывод, что выделяющаяся теплота не зависит от того, каким образом осуществляется данная реакция. Закон Гесса является следствием закона сохранения энергии.
Если при химической реакции давление остается постоянным, то выделяющаяся энергия частично может расходоваться на работу при увеличении объема от  до
до  .
.
Теплота, выделяющаяся при реакции, идет на увеличение внутренней энергии и на работу:
 .
.
Выделяющуюся теплоту можно представить в виде разности функций:
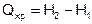 ,
,
где  , функция состояния, называемая энтальпией.
, функция состояния, называемая энтальпией.
Энтальпия зависит от внутренней энергии, давления и объема.
Изменение энтальпии не зависит от пути перехода системы из одного состояния в другое, а зависит только от параметров начального и конечного состояний. Таким образом, энтальпия – есть функция состояния.
Энтальпия может быть использована для определения количества теплоты, выделяемого или поглощаемого при химических реакциях.
|
|
|
Найдем производную по температуре от энтальпии.
 .
.
При изохорном процессе теплоемкость равна производной по температуре от внутренней энергии,  .
.
При изобарном процессе теплоемкость равна производной по температуре от энтальпии.
 .
.
Энтальпия в данном случае играет ту же роль, что и внутренняя энергия.
Если давление не постоянно, то первый закон термодинамики можно записать в виде 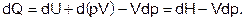
Теплоемкость системы, исходя из этого уравнения, можно найти по формуле:
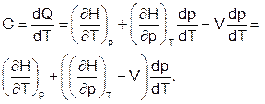
Изменение энтальпии при произвольном процессе изменения состояния идеального газа определяется формулой:  .
.
Итак, с помощью энтальпии можно определить теплоту, выделяющуюся при химических реакциях, а также при многих других процессах, происходящих в системе.
Примеры решения задач.
Задача 1. Покажите, что изобарный и изохорный процессы также являются частными случаями политропного процесса.
Решение.
Для изобарного процесса 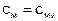 .
.

Подставив n в выражение  .
.
Перепишем уравнение (9) в виде
 . (10)
. (10)
При изохорном процессе

Тогда 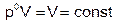 .
.
Задача 2. Определите работу, совершаемую при изотермическом расширении реального газа.
Решение.
Воспользуемся уравнением Ван-дер-Ваальса и выразим давление
 .
.
Работа газа 
 .
.
Задача 3. Молярная теплоемкость изменяется с температурой по закону:  . Вычислите изменение энтальпии одного моля
. Вычислите изменение энтальпии одного моля 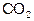 при нагревании от 350 до 450 К при давлении, равном 1 атм.
при нагревании от 350 до 450 К при давлении, равном 1 атм.
Для углекислого газа α = 25,503 Дж/(моль·К), β = 42,262 Дж/(моль·К2), γ = -142,4·10-7 Дж/(моль·К3).
Решение.

Подставим числовые значения.
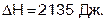
Упражнения 2.
1. При нагревании 1 кг неизвестного газа на 1 К при постоянном давлении требуется 912 Дж, а при постоянном объеме 649 Дж. Что это за газ?
2. Нагревается или охлаждается газ, расширяющийся по закону  ?
?
3. Газ, занимавший объем 2 л при давлении 0,1 МПа, расширился изотермически до 4 л. После этого, охлаждая газ изохорически, уменьшили его давление в 2 раза. Далее газ изобарически расширился до 8 л. Найдите работу, совершенную газом.
4. Определите изменение внутренней энергии 1 л  при давлении 2 атм и температуре 298,15 К при повышении температуры на 10 К. Газ считать идеальным.
при давлении 2 атм и температуре 298,15 К при повышении температуры на 10 К. Газ считать идеальным.
5. При температуре 300 К 1 моль углекислого газа занимает объем 1,5 л. Определите давление газа в первом случае считая его идеальным, а во втором из уравнения Ван дер Вальса. а = 3,59 л2 атм/моль; b = 0,0427 л/моль.
|
|
|
6. В каких случаях при фазовых переходах выделяется, а в каких случаях поглощается теплота. Почему мы используем термин «скрытая» теплота плавления и кипения?
7. Относительная влажность воздуха при температуре 20° равна  = 70%.Какова станет влажность воздуха в закрытом помещении, если температура в помещении повысится до
= 70%.Какова станет влажность воздуха в закрытом помещении, если температура в помещении повысится до
35°? Какова станет влажность воздуха в закрытом помещении, если температура в помещении понизится до 10°? Давления насыщенного пара при температурах 10°, 20° и
35° соответственно равны 1,23, 2,33 и 4,45 кПа.
|
|
|


