 |
Применение I начала термодинамики к изопроцессам
|
|
|
|
Первое начало термодинамики
Рассмотрим термодинамическую систему (газ), внутренняя энергия которой U изменяется за счет совершения над системой работы A и за счет сообщения ей некоторого количества теплоты Q.
Первое начало термодинамики утверждает (на основе обобщения многовековых опытных данных), что

Формулу можно переписать в виде

теплота, сообщенная системе, расходуется на увеличение ее внутренней энергии и на совершение работы против внешних сил. Для малых изменений системы имеем

Если термодинамическая система периодически возвращается в исходное состояние, то изменение внутренней энергии равно нулю ( ), и вся подведенная к системе теплота может быть, согласно первому началу термодинамики, переведена в работу
), и вся подведенная к системе теплота может быть, согласно первому началу термодинамики, переведена в работу  . Причем, нельзя построить периодически действующий двигатель, который совершал бы работу, большую, чем количество сообщающейся ему извне энергии, или невозможен вечный двигатель 1-го рода.
. Причем, нельзя построить периодически действующий двигатель, который совершал бы работу, большую, чем количество сообщающейся ему извне энергии, или невозможен вечный двигатель 1-го рода.
Первое начало термодинамики – это закон сохранения энергии в термодинамике.
Работа газа при изменении его объема
Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде.
Газ, расширяясь, передвигает поршень на расстояние dl и производит работу

где  – площадь поршня;
– площадь поршня; 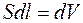 – изменение объема.
– изменение объема.
Таким образом, работа при расширении газа определяется как


| Работа в процессе 1–2
интегрирование формулы

|
| Рис. |
При расширении газа  работа положительна
работа положительна  , то есть газ совершает работу, при сжатии
, то есть газ совершает работу, при сжатии  , т. е. работа совершается над газом.
, т. е. работа совершается над газом.
Теплоемкость идеального газа
Удельная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 к и определяется как
|
|
|

Молярная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания 1 моля на 1 к

где  – число молей.
– число молей.
Удельная теплоемкость связана с молярной теплоемкостью соотношением:

где М – молекулярная масса.
Найдем выражения для молярной теплоемкости в изохорном и изобарном процессах. Для этого запишем первое начало термодинамики для 1-го моля газа

При V = constвсе сообщенное газу тепло идет на увеличение его внутренней энергии, т. е.

При  из
из

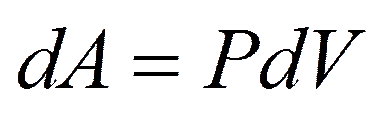

из уравнения Клапейрона – Менделеева имеем

Уравнения Майера


Таким образом, теплоемкость в изобарном процессе равна

Из формулы следует, что  всегда больше
всегда больше 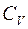 на величину газовой постоянной R. Это объясняется тем, что при нагревании газа при постоянном давлении требуется дополнительное количество теплоты на совершение работы расширения газа. Отсюда вытекает физический смысл универсальной газовой постоянной R – это работа, которую надо совершить при изобарическом нагревании 1 моля газа на 1 К.
на величину газовой постоянной R. Это объясняется тем, что при нагревании газа при постоянном давлении требуется дополнительное количество теплоты на совершение работы расширения газа. Отсюда вытекает физический смысл универсальной газовой постоянной R – это работа, которую надо совершить при изобарическом нагревании 1 моля газа на 1 К.
Отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме можно выразить как

Применение I начала термодинамики к изопроцессам
Среди равновесных процессов, происходящих в термодинамических системах (газах), выделяют изопроцессы, при которых один из параметров состояния остается постоянным.
Изохорный процесс (V = const). В координатах P, V изохорный процесс изображается прямой параллельной оси ординат (рис. 6.3, а). В изохорном процессе газ не совершает работы, т. е.  . Тогда из первого начала термодинамики количество теплоты выражается зависимостью вида:
. Тогда из первого начала термодинамики количество теплоты выражается зависимостью вида:



| Таким образом, в изохорном процессе все тепло, сообщенное газу, идет на увеличение его внутренней энергии. | |
| Рис. |
Изобарный процесс (P = const). Диаграмма этого процесса (изобара) изображается прямой параллельной оси x. Работа при расширении газа от V 1 до V 2 определяется как
|
|
|

Работа численно равна площади заштрихованного прямоугольника на рис. Если воспользоваться уравнением Менделеева – Клапейрона ( ), откуда следует, что
), откуда следует, что  ,
,

С учетом полученных выражений первое начало термодинамики для изобарного процесса в дифференциальной форме можно представить в виде

Изотермический процесс (T = const). Уравнением изотермического процесса является закон Бойля-Мариотта

Диаграмма изотермического процесса приведена на рис.
Работа в изотермическом процессе (T = const) может быть определена как

 Рис. 6.4
Рис. 6.4
| Согласно первому началу термодинамики  так как так как  при при  В изотермическом процессе все количество теплоты, сообщаемое газу, расходуется им на совершение работы против внешних сил
В изотермическом процессе все количество теплоты, сообщаемое газу, расходуется им на совершение работы против внешних сил
|

Теплоемкость изотермического процесса стремится к бесконечности, т. е.

Адиабатический процесс
Адиабатическим называется процесс, при котором отсутствует теплообмен между термодинамической системой и окружающей средой 
Из первого начала следует, что

или
 (1)
(1)
Найдем уравнение, связывающее параметры состояния в адиабатном процессе. Для этого продифференцируем уравнение состояния для 1 моля газа
 (2)
(2)
Разделив уравнение (2) на выражение (1), получим

Разделим переменные, тогда с учётом 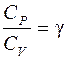 выражение примет вид
выражение примет вид

Интегрируя в пределах от Р 1 до Р 2 и от V 1 до V 2, получим
 ;
;
или
 или
или 
Так как состояния 1 и 2 выбраны произвольно, то можно записать: 
Уравнение называется уравнением Пуассона, которое описывает адиабатический процесс. Используя уравнения Клапейрона – Менделеева, можно записать уравнение Пуассона в виде

или

где g – коэффициент Пуассона, равный  ; при i = 3g = 1,67, при i = 5, g = 1,4.
; при i = 3g = 1,67, при i = 5, g = 1,4.
График адиабаты представлен на рис. Адиабата более крута, чем изотерма. Это объясняется тем, что увеличение давления газа обусловлено не только уменьшением объема как при изотермическом сжатии, но и повышением температуры. При адиабатическом процессе изменяются все три параметра P, V и T.

| Вычислим работу, совершаемую газом при адиабатическом процессе:
 Интегрируя выражение
Интегрируя выражение
|
| Рис.6.5 |

Работа, совершаемая газом при адиабатическом процессе, численно равная заштрихованной площади на рис., меньше, чем при изотермическом процессе.
|
|
|
Политропный процесс
Все рассмотренные выше процессы обладают одной общей особенностью – они происходят при постоянной теплоемкости С
при 
при 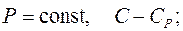
при 
при 
Процессы, в которых теплоемкость постоянна, называют политропными. Все изопроцессы, включая адиабатический, являются частными случаями политропного процесса.
Аналогично выводу уравнения адиабаты, используя первое начало термодинамики и уравнение Менделеева – Клапейрона для 1 моля,

получим

Интегрируя выражение, получим уравнение политропы

Заменив в температуру T соотношением, полученным из уравнения Менделеева – Клапейрона, как  , получим
, получим
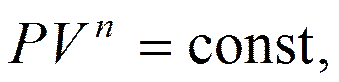
где  – показатель политропы.
– показатель политропы.
При 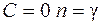 получим
получим 
 – уравнение изотермы;
– уравнение изотермы;
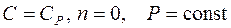 – уравнение изобары;
– уравнение изобары;
 – уравнение изохоры.
– уравнение изохоры.
|
|
|


