 |
Строение двойного электрического слоя
|
|
|
|
В отсутствие теплового движения частиц строение двойного электрического слоя было бы подобно строению плоскогоконденсатора. Но в отличие от идеального случая, ДЭС в реальных условиях имеет диффузное (размытое) строение. Согласно современной теории структуру ДЭС составляют два слоя:
· Слой Гельмгольца или адсорбционный слой, примыкающий непосредственно к межфазной поверхности. Этот слой имеет толщину δ, равную радиусу потенциалопределяющих ионов внесольватированном состоянии.
· Диффузный слой или слой Гуи, в котором находятся противоионы. Диффузный слой имеет толщину λ, которая зависит от свойств системы и может достигать больших значений. Толщина диффузного слоя рассчитывается по формуле:
Λ=
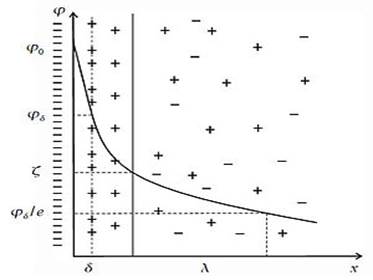
Рис. Строение ДЭС
Электрической характеристикой ДЭС является потенциал φ. Существует несколько характеристических потенциалов:
· Потенциал диффузного слоя φδ, соответствующий границе адсорбционного и диффузного слоёв. Внутри диффузного слоя потенциал можно рассчитать по уравнению Гуи-Чепмена:
φ=φδe-μx
· Потенциал φx=λ, меньший, чем φδ в e раз и характеризующий толщину диффузного слоя.
· Электрокинетический потенциал или дзета-потенциал. Этот потенциал соответствует плоскости скольжения и является частью потенциала диффузного слоя. Плоскость скольжения образуется в результате того, что при движении дисперсных частиц наиболее удаленная часть диффузного слоя не участвует в движении, а остается неподвижной. Поэтому появляется нескомпенсированность поверхностного заряда частицы и становятся возможными электрокинетические явления. Дзета-потенциал является одной из важнейших характеристик двойного электрического слоя.
|
|
|
СЖАТИЕ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ
ДЭС создает энергетический барьер препятствующий слипанию частиц, при столкновении друг с другом. Под действием электролита добавленная в дисперсную систему, происходит нарушение равновесия – концентрация катионов и анионов в дисперсной среде. Превышает концентрация катионов в диффузном слое. В результате добавленный электролит начинает занимать положение в диффузном слое. А катионы в диффузном слое начинают перемещаться к абсорбционным.
Происходит сжатие ДЭС. При некотором концентрации электролита все катионы могут расположиться в абсорбционном слое, то есть диффузный слой исчезает. В этом случае двойной электрический слой перестает служить энергетическим барьером, предохраняющий частицы от слипания друг с другом под действием молекул сил притяжения.
ТЕОРИЯ ДЛФО
Первые количественные расчеты были произведены. В. В. Дерягиным в конце 30-хгодов и затем завершены в работе В. В. Дерягина и Л. Д. Ландау (1941 г.). Аналогичный подход к изучению устойчивости коллоидных систем в дальнейшем был развит и в работах голландских исследователей Фервея и Овербека. По начальным буквам основных авторов возникшей физической теории коагуляции эту теорию теперь часто называют теорией ДЛФО. Силы взаимодействия, проявляющиеся между мицеллами коллоидной системы, имеют сложную природу и в основном определяются следующими видами:
Силы притяжения, обусловленные Ван-дер-Ваальсовскими силами притяжения между агрегатами мицелл.
Силы отталкивания.
1) Термодинамическая составляющая сил отталкивания, обусловленная термодинамической устойчивостью тонких жидких пленок на границе фаз. Эта составляющая играет большую роль для лиофильных коллоидных систем. В основе термодинамики агрегативной устойчивости лежит представление о расклинивающем давлении, введенное Б. В. Дерягиным в 1935 г. Расклинивающее давление возникает при сильном уменьшении толщины пленки в результате взаимодействия сближающихся поверхностных слоев. Пленкой называют часть системы, находящуюся между двумя межфазными поверхностями. Расклинивающее давление является избыточным по сравнению с давлением в той фазе, частью которой является рассматриваемая пленка. Расклинивающее давление является суммарным параметром, учитывающим как силы отталкивания, так и силы притяжения, действующие в пленке. В соответствии с этим расклинивающее давление может быть положительным (отталкивание поверхностных слоев) и отрицательным (притяжение поверхностных слоев).
|
|
|
2) Электростатическая составляющая сил отталкивания. Для лиофобных систем силы отталкивания определяются только ионно-электростатическим отталкиванием одноименно заряженных диффузных слоев мицелл.
В зависимости от соотношения этих сил возможны два варианта поведения коллоидного раствора:
1)Если преобладает сила притяжения (| fd | >| fe |), то дисперсные частицы сближаются, между ними возникает контакт, и они объединяются в более крупный агрегат (коллоидный «димер»). Таким образом, в этом случае элементарный акт процесса коагуляции может состояться.
2)Если преобладает электростатическое отталкивание (| fd | <| fe |), то частицы могут не вступать в непосредственное соприкосновение, и коагуляция золя не происходит.
Таким образом, в качестве основного фактора термодинамической устойчивости
дисперсной системы в теории ДЛФО принимают электростатическое (кулоновское) отталкивание дисперсных частиц.
Для расчета условий коагуляции вводятся дополнительные концепции:
1)Частицы имеют призматическую форму и разделены плоскопараллельным зазором шириной h (см. рис.).
2)Частицы перемещаются только в направлении, перпендикулярном зазору. Броуновское движение исключается.
Для расчета условий сопоставляются не силы притяжения, а соответствующие им энергии
взаимодействия (Ud, Ue).
Ud=
где A 1*,2 – сложная константа Гамакера; знак«–»указывает на взаимное притяжение.
Энергия электростатического взаимодействия (Ue) создается вследствие перекрывания диффузных слоев противоионов в тонкой пленке раствора электролита в зазоре между частицами.
|
|
|
Ue, которая зависит от толщины пленки, создает в пленке дополнительное давление – расклинивающее давление (Π). Π – это термодинамический параметр тонкой жидкой пленки в пространстве между частицами:
где Wf – это работа, которую нужно затратить для увеличения поверхности тонкой пленки на единицу площади при постоянной температуре.
Wf 2 Wf,
где Wf – это дополнительная энергия пленки, которую нужно затратить для сближения поверхностных слоев ABB′A′ и CDD′C′.
По физическому смыслу величину Wf можно рассматривать как энергетическое определение поверхностного натяжения тонкой пленки.
Физический смысл величины Π – это избыточное давление в тонкой пленке по сравнению с гидростатическим давлением в большом объеме жидкости.
(h) pf po,
где pf – давление в тонкой пленке.
Положительное расклинивающее давление препятствует утоньшению пленки! Возникновение Π связано с поверхностными силами разной природы (электрическими,
магнитными, молекулярными). Для коллоидной химии особенно важны первые и последние. При толщине жидкой пленки 1 мкм Π может достигать 400 Па, а 0,04 мкм – 1,88∙104 Па.
Необходимо уяснить, что Ue и Ud имеют разные знаки и поразному зависят от толщины разделяющей пленки h:

Рисунок 35 – Изменение энергии (U) тонкой пленки электролита в зависимости от ее толщины (h)
Как видно из рисунка, Ue изменяется по экспоненциальному закону (пропорциональна e - æh), Ud – по степенному (пропорциональна 1 /h2). Поэтому на малых расстояниях будет преобладать притяжение (при h → 0 Ud → ∞). На больших расстояниях также преобладает притяжение, т. к. степенная функция убывает медленнее, чем экспонента. На средних расстояниях возможен локальный (дальний) максимум. Он соответствует энергетическому (потенциальному) барьеру, который препятствует сближению частиц и их коагуляции.
Анализ уравнения и графика позволяет выделить три случая поведения дисперсной системы в зависимости от соотношения высоты энергетического барьера UM, глубины потенциальной ямы UN на больших расстояниях, и на малых расстояниях энергии тепловых колебаний kT.
|
|
|
Устойчивость коллоидных систем определяется балансом сил отталкивания и притяжения. При рассмотрении коагуляции коллоидных систем следует различат два предельных случая:
1) нейтрализационную коагуляцию когда потеря устойчивости происходит в результате разряжения коллоидных частиц и уменьшения их φ-потенциалаНейтрализационная коагуляция наблюдается у золей со слабо заряженными частицами, обладающими сравнительно низкими значениямиφ-потенциала.В этом случае коагуляция происходит у золей при снижении электрического заряда частиц из-за уменьшения адсорбции потенциалопределяющих ионов. В ре зультате уменьшения заряда электрические силы отталкивания между частицами ослабевают, частицы при сближении выпадают в осадок.
2) концентрационную коагуляцию при которой потеря устойчивости связана не с падениемφ-потенциала,а вызвана сжатием диффузного двойного слоя.
Концентрационная коагуляция наблюдается обычно у золей с сильно заряженными частицами при увеличении концентрации индифферентного электролита в системе. Это обстоятельство позволяет в первом приближении вовсе не учитывать возможное изменение φ- потенциала при различного рода адсорбционных или десорбционных явлениях. Единственной причиной коагуляции системы в этом случае является, согласно теории ДЛФО, чисто электростатический эффект сжатия двойного электрического слоя. В предельном случае потенциал поверхности —φ - потенциал— при коагуляции может сохранять достаточно высокие значения (более 100 мВ). При этом соответствие между с потенциалом, который при увеличении концентрации раствора электролита может значительно падать, иφ-потенциаломтеряется. Теряется также связь между устойчивостью системы и - и φ- иζ-потенциалами.Таким образом, становится понятным, почемуζ-потенциалдалеко не всегда можёт являться критерием устойчивости золя.
Теория показывает, что по мере безграничного возрастания φ-потенциала обеих поверхностей сила электростатического отталкивания между частицами любой формы не возрастает безгранично, а стремится к конечному пределу, подходя к нему уже при значениях потенциала поверхности, превышающих 100 мВ. Вследствие этого свойства, как бы насыщения сил, можно говорить о силе взаимодействия предельно заряженных поверхностей как о величине, не зависящей от точных значений потенциала поверхности. Этот вывод объясняется тем, что по мере роста φ-потенциала увеличивается притяжение противоионов к поверхности частицы. Таким образом, параллельно с ростом заряда внутренней обкладки двойного электрического слоя и потенциала поверхности усиливается и экранирование внешнего поля этой обкладки противоионами. Поэтому дальнейший рост напряженности электрического поля в периферийных частях ионных атмосфер и сил взаимодействия обеих частиц прекращается. Таким образом, если коллоидные частицы заряжены достаточно сильно, то их взаимодействие зависит только от заряда противоионов, экранирующих действие внутренней обкладки двойного слоя и обусловливающих его толщину. При прибавлении к системе индифферентного электролита происходит сжатие диффузной части двойного электрического слоя и толщина ионных атмосфер уменьшается. Одновременно также в результате сжатия ионного слоя увеличивается глубина вторичного потенциального минимума, что приводит к возрастанию вероятности дальней агрегации.
|
|
|

Рисунок 36 – Изменение вида результирующих кривых, характеризующих взаимодействие частиц, при увеличении содержания электролита
Энергетический барьер на диаграмме энергия взаимодействия – расстояние между коллоидными частицами исчезает когда достигнут порог коагуляции
C= kT5/A2e6z6
где С – константа зависящая от отношения числа зарядов катиона и аниона, е – заряд электрона, z – валентность противоиона, А – постоянная притяжения.
Минимальная концентрация электролита, которая вызывает начало процесса коагуляции называется порогом коагуляции к (моль/дм3). Она является постоянной величиной для данной парызоль–электролитпри одинаковых внешних условиях (температура, давление и т. п.). Иногда используют величину, обратную порогу коагуляции, – коагулирующую способность электролита
Vк.
В случае сильного заряда поверхности к обратно пропорциональна заряду противоиона (ze)6. Этот вывод дает теоретическое обоснование правила Шульце-Гарди. При сильном заряде поверхности снижение энергетического барьера вызывает и сжатие диффузного слоя противоионов при введении электролитов в достаточно высокой концентрации. Напомним, что такой случай называют концентрационной коагуляцией.
СТРОЕНИЕ МИЦЕЛЛ.
Мицелла – сложное структурное образование, состоящее из агрегата, потенциалопределяющих ионов и противоионов.
Внутреннюю часть мицеллы составляет агрегат основного вещества. Как правило, агрегат состоит из большого числа молекул или атомов кристаллического или аморфного строения. Агрегат электронейтрален, но обладает большой адсорбционной способностью и способен адсорбировать на своей поверхности ионы из раствора – потенциалопределяющие ионы (ПОИ).
При выборе потенциалопределяющих ионов пользуются эмпирическим правилом Фаянса – Панета – Пескова: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые:
· входят в состав агрегата;
· способны достраивать кристаллическую решетку агрегата;
· образуют малорастворимое соединение с ионами агрегата;
· изоморфны с ионами агрегата».
Агрегат вместе с потенциалопределяющими ионами составляет
ядро мицеллы. Ядро мицеллы, обладающее большим зарядом, притягивает ионы противоположного заряда – противоионы (ПИ) из раствора.
Часть противоионов находится в непосредственной близости от ядра, прочно связана с ним за счет адсорбционных и электростатических сил, и образует плотную часть двойного электрического слоя (адсорбционный слой).
Ядро с противоионами плотной части двойного электрического слоя образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда потенциалопределяющих ионов.
Коллоидную частицу (гранулу) окружают противоионы диффузного слоя – остальная часть противоионов, подвергающихся броуновскому движению и менее прочно связанная с ядром. В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна.
Пример 4.2. Рассмотрим строение мицеллы при образовании коллоидного раствора – золя иодида серебра методом химической конденсации при небольшом избытке нитрата серебра


Рис. 4.11. Схематическое строение мицеллы золя иодида серебра
Формула мицеллы запишется:

где m – количество молекул или атомов, образующих агрегат; n – число потенциалопределяющих ионов, адсорбированных на поверхности агрегата; (n – x) – число противоионов в плотной части двойного электрического слоя (адсорбционный слой); x – число противоионов в диффузной части двойного электрического слоя; 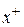 – заряд коллоидной частицы (гранулы).
– заряд коллоидной частицы (гранулы).
При образовании золя иодида серебра при небольшом избытке иодида калия

образуется мицелла следующего состава:

Заряд коллоидной частицы в этом случае будет отрицательным.
Формулы мицелл золей носят только качественный характер, они позволяют судить о структуре поверхностных слоев, но не пригодны для количественной характеристики состава мицелл. Существование мицелл в дисперсных системах приводит к тому, что состав дисперсионной среды вдали и вблизи частиц различается. Если, например, диффузный слой содержит ионы H+, то при фильтровании суспензий эти ионы уходят вместе с частицами. В результате возникает повышенная концентрация ионов H+ в осадке по сравнению с фильтратом. Это явление получило название суспензионного эффекта.
Образование ДЭС в присутствии электролита-стабилизатора обеспечивает электростатический фактор устойчивости дисперсной системе, который усиливается с ростом потенциала поверхности и толщины ДЭС. Он очень чувствителен к действию электролитов и характерен для систем с полярными, особенно водными средами, создающими условия для диссоциации. Наряду с электростатическим, в дисперсных схемах возможно проявление и других факторов стабилизации.
|
|
|


