 |
Получение и свойства карбоновых кислот
|
|
|
|
Теоретическая часть
Карбоновые кислоты – органические вещества, молекулы которых содержат одну или несколько карбоксильных групп –СООН, соединённых с углеводородным радикалом или водородным атомом.
Физические свойства
Низшие карбоновые кислоты – это жидкости с острым запахом, растворимы в воде. Высшие карбоновые кислоты – твёрдые вещества без запаха, не растворимы в воде. Муравьиная кислота – средней силы, уксусная – слабая.
Химические свойства
6. Диссоциация (слабые кислоты, меняют окраску индикаторов)
CH3COOH CH3COO - + H+
7. Взаимодействие с металлами
2CH3COOH + Mg → (CH3 –COО)2Mg + H2
8. С оксидами
CH3COOH + MgO → (CH3 –COO)2Mg + H2O
9. С гидроксидами
CH3COOH + NaOH → CH3COONa + H2O
10. С солями более слабых и летучих кислот
2CH3COOH + Na2CO3 → CH3COONa + H2CO3 (разлагается на H2O и CO2)
11. Со спиртами (реакция этерификации)
CH3COOH + С2Н5ОН →СН3СООС2Н5 +Н2О
уксусно-этиловый эфир
Получение.
В лаборатории карбоновые кислоты, как и неорганические, можно получить из их солей, действуя на них серной кислотой при нагревании:
2CH3COONa + H2SO4 → Na2SO4 + 2CH3COOH
Экспериментальная часть
ЦЕЛЬ РАБОТЫ: изучить свойства уксусной кислоты.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, стружки магния, гранулы цинка, концентрированная серная кислота, раствор уксусной кислоты, раствор хлорида натрия, оксид меди (II), этанол, спиртовка.
ОПЫТ 1. ВЗАИМОДЕЙСТВИЕ УКСУСНОЙ КИСЛОТЫ С МЕТАЛЛАМИ.
В две пробирки влейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, во вторую – несколько гранул цинка.
Что наблюдаете? Напишите уравнение реакции.
ОПЫТ 2. ВЗАИМОДЕЙСТВИЕ УКСУСНОЙ КИСЛОТЫ С ОКСИДОМ МЕДИ (II).
В сухую пробирку помещаем 2 капли этилового спирта, 2 капли раствора перманганата калия и 3 капли раствора серной кислоты. Осторожно нагреваем содержимое пробирки над пламенем спиртовки.
|
|
|
Что наблюдаете? Напишите уравнение реакции.
ОПЫТ 3. ВЗАИМОДЕЙСТВИЕ УКСУСНОЙ КИСЛОТЫ С ЭТАНОЛОМ (РЕАКЦИЯ ЭТЕРИФИКАЦИИ).
В пробирку налейте 1 мл ледяной уксусной кислоты, затем 0,5 мл концентрированной серной кислоты. Далее прилейте 1 мл этанола. Встряхните содержимое пробирки и осторожно подогрейте. Влейте жидкость в пробирку с насыщенным раствором хлорида натрия.
Что наблюдаете? Напишите уравнение реакции.
Задания.
1. Какие органические вещества называются карбоновыми кислотами? Как их классифицируют?
2. Напишите структурные формулы возможных изомерных кислот и сложных эфиров, соответствующих формуле С4Н8О2. Назовите их.
3. Дайте сравнительную характеристику органических и неорганических кислот. В чем сходство и различие?
4. Что такое реакция этерификации? Напишите реакцию взаимодействия изоамилового спирта и уксусной кислоты.
5. Укажите основные способы получения карбоновых кислот.
ЛАБОРАТОРНАЯ РАБОТА № 14
РАСТВОРИМОСТЬ ЖИРОВ,
ДОКАЗАТЕЛЬСТВО ИХ НЕПРЕДЕЛЬНОГО ХАРАКТЕРА.
Теоретическая часть
Жиры – сложные эфиры трёхатомного спирта глицерина и высших карбоновых кислот.
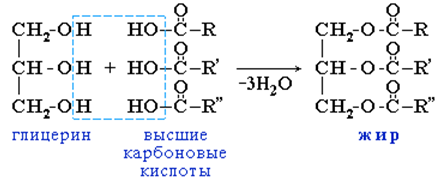
Физические свойства
Жиры – легкоплавкие вещества, легче воды, нерастворимы в воде, растворимы в органических растворителях, имеют низкую теплопроводность. Животные жиры – твёрдые, растительные жиры (масла) – жидкие. В состав животных жиров входят преимущественно насыщенные кислоты: стеариновая С17Н35СООН, пальмитиновая С15Н31СООН, в состав растительных масел входят ненасыщенные кислоты: олеиновая С17Н33СООН, линолевая С17Н31СООН.
При комнатной температуре жиры (смеси триглицеридов) – твердые, мазеобразные или жидкие вещества. Как любая смесь веществ, они не имеют четкой температуры плавления (т.е. плавятся в некотором диапазоне температур). Определенной температурой плавления характеризуются лишь индивидуальные триглицериды.
|
|
|
Химические свойства
1. Гидролиз жиров. Жиры гидролизуются с образованием глицерина и карбоновых кислот:
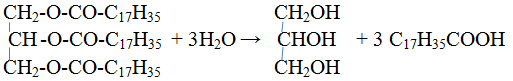
2. Гидрирование масел. Жидкие растительные масла превращаются в твёрдые
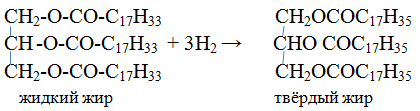
3. Получение мыла. Мыла – соли щелочных металлов высших карбоновых кислот

Применение - жиры – ценный продукт питания, служат для получения глицерина, карбоновых кислот, мыла, гидрированный жир служит для получения маргарина.
Жиры в природе. Жиры входят в состав животных и растительных организмов, служат источником энергии. При пищеварении жиры под действием ферментов распадаются на глицерин и карбоновые кислоты.
Экспериментальная часть
ЦЕЛЬ РАБОТЫ: изучить растворимость жиров в различных растворителях. Обнаружить непредельность жиров, выделение свободных жирных кислот из мыла.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, хлороформ, этанол, концентрированная серная кислота, дистиллированная вода, подсолнечное масло, йодная вода, бензол, разбавленный раствор мыла, раствор серной кислоты.
ОПЫТ 1. РАСТВОРИМОСТЬ ЖИРОВ.
В одну пробирку налейте 2 мл воды, во вторую – хлороформа, в третью – этанола, в четвертую - бензола. Во все пробирки с веществами прилейте 2 мл подсолнечного масла.
Опишите свои наблюдения.
ОПЫТ 2. ОПРЕДЕЛЕНИЕ НЕПРЕДЕЛЬНОСТИ ЖИРОВ.
В пробирку помещаем 2 мл подсолнечного масла и добавляем 2 мл бромной воды.
Что наблюдаете? Напишите уравнение реакции.
ОПЫТ 3. ВЫДЕЛЕНИЕ СВОБОДНЫХ ЖИРНЫХ КИСЛОТ ИЗ МЫЛА.
В пробирку налейте 2 мл раствора хозяйственного мыла, затем добавим 2 мл раствора серной кислоты.
Что наблюдаете? Напишите уравнение реакции.
Задания.
1. Что такое жиры?
2. Какое различие существует в строении твердых и жидких жиров?
3. Назовите важнейшие ВКК, входящие в состав жиров.
4. Каковы химические свойства жиров? Приведите уравнения реакций на примере тристеарина.
5. Составьте уравнения реакций получения: а) триолеина; б) олеолинолеопальмитина.
6. Что такое мыла?
7. Что такое твердое мыло, жидкое мыло?
8. Какими недостатками обладают мыла?
|
|
|
ЛАБОРАТОРНАЯ РАБОТА № 15
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ.
Теоретическая часть
Белки – это природные полимеры, состоящие из большого числа остатков α-аминокислот, связанных между собой пептидными связями.
Свойства белков весьма разнообразны, которые они выполняют. Одни белки растворяются в воде, образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей).
Денатурация – разрушение вторичной, третичной структуры белка под действием различных факторов: температура, действие кислот, солей тяжёлых металлов, спиртов и т.д.
При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, то есть ее пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются. Изменяются физические свойства: сни- жается растворимость, способность к гидратации, теряется биологическая актив-ность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых групп, облегчается воздействие на белки протеолитических ферментов, а, следовательно, он легче гидролизуется.
Качественные реакции на белки:
а) При горении белка – запах палёных перьев.
б) Ксантопротеиновая–происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением желтой окраски;
Белок +HNO3(конц) → жёлтая окраска
в) Биуретовая – происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди(II) с образованием комплексных соединений между ионами Cu2+ и полипептидами. Реакция сопровождается появлением фиолетово–синей окраски;
Раствор белка +NaOH + CuSO4 → фиолетовая окраска
г) Цистеиновая реакция – происходит при нагревании белков со щелочью в присутствии солей свинца выпадает черный осадок, который содержит серу.
|
|
|
Раствор белка +NaOH+Pb(CH3COO)2 → черное окрашивание
Гидролиз
Белок + Н2О → смесь аминокислот
Функции белков в природе:
· ферментативная функция;
· транспортная функция;
· структурная функция;
· защитная функция;
· сигнальная функция.
Ферментативная функция белков заключается в том, что они служат катализаторами различных химических реакций, протекающих в организме. Ферментативную функцию по-другому называют каталитической. При катализе происходит ускорение химических реакций, причем это ускорение может быть даже в миллионы раз.
Белков-ферментов тысячи, каждый из них обслуживает свою химическую реакции или группу схожих реакций. По типу обслуживаемых реакций ферменты делят на классы. Например, оксидоредуктазы катализируют окислительно-восстановительные реакции, гидролазы обеспечивают гидролиз химических связей и т. д.
Реакцию катализирует не вся молекула фермента, а только ее так называемый активный центр. Он включает часть молекулы, которая связывает субстрат (молекулу, которая подвергается превращению), и несколько аминокислот (часто не вместе расположенных), которые обеспечивают саму реакцию.
Белки выполняют структурную функцию. Они входят в состав клеточных мембран и органоидов, межклеточного вещества (белки коллаген и эластин), волос, ногтей и т. п. (кератин).
Двигательная функция белков заключается в сокращении мышц (актин и миозин), обеспечении движения клеток, их ресничек и жгутиков.
Существуют белки, которые обеспечивают перенос различных веществ как внутри клетки, так и по всему организму. Такие белки обеспечивают транспортную функцию. Они легко связываются с субстратом, когда его концентрация высока, и легко высвобождают его при низкой концентрации. К транспортным белкам относится гемоглобин. В легких он связывает кислород и высвобождает углекислый газ, а в тканях наоборот.
Ряд белков, входящих в состав мембран клеток, обеспечивают транспорт малых молекул через мембрану. Такой транспорт может быть как пассивным (белки-каналы), так и активным (белки-переносчики).
Регуляторная и сигнальная функции белков разнообразны. Многие внутриклеточные процессы (клеточный цикл, транскрипция и трансляция, активация или подавление активности других белков и т. д.) регулируются белками.
Многие гормоны — это белки, переносимые кровью. Когда гормон связывается с определенным рецептором, то клетка получает сигнал, в результате чего в ней запускается ответная реакция. Гормоны регулируют концентрации веществ, процесс роста, период размножения и др.
|
|
|
Клетки взаимодействуют между собой посредством сигнальных белков, которые передаются через межклеточное вещество. Например, такие сигналы могут стимулировать или подавлять рост клеток. Таким образом обеспечивается согласованность работы клеток той или иной системы органов.
Выделяют рецепторную функцию белков. Белки-рецепторы могут находиться как в цитоплазме, так и в мембранах. Когда на рецептор действует химическое вещество или физический стимул (свет, давление и др), то он изменяется. Это изменение молекулы передается в другие части клетки, посредством катализа определенной реакции, прохождения ионов или связывания молекул-посредников.
Защитная функция белков также весьма разнообразна. Коллаген и кератин обеспечивают не только структурную функцию, но и физическую защиту организма. Также физически организм защищают фибриногены и тромбины, свертывающие кровь в местах ранения (контакта с воздухом).
Белки обеспечивают химическую защиту, связывая и расщепляя чужеродные токсины или вырабатывая свои (для защиты от других организмов).
Защитными белками являются антитела, которые обезвреживают микроорганизмы и чужеродные белки. Так белки обеспечивают иммунную защита.
Если в организме возникает дефицит углеводов и жиров, то белки, распадаясь до конечных продуктов, могут выполнять энергетическую функцию.
Белки могут запасаться как источник энергии и источник аминокислот (например, в яйцеклетках). Это запасающая функция белков.
Экспериментальная часть
ЦЕЛЬ РАБОТЫ: изучить основные свойства белков.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, спиртовка, этанол, концентрированная азотная кислота, дистиллированная вода, яичный белок, раствор гидроксида натрия, раствор сульфата меди (II).
ОПЫТ 1. СВЕРТЫВАНИЕ БЕЛКОВ ПРИ НАГРЕВАНИИ.
В пробирку налейте 2 мл раствора яичного белка и осторожно нагрейте до кипения.
Опишите свои наблюдения.
ОПЫТ 2. ДЕНАТУРАЦИЯ БЕЛКОВ.
В пробирку помещаем 2 мл раствора яичного белка и добавляем 2 мл неразбавленного этанола.
Опишите свои наблюдения.
ОПЫТ 3. ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ.
Биуретовая реакция.
В пробирку налейте 2 мл раствора яичного белка, затем добавьте 2 мл раствора гидроксида натрия, а затем немного раствора сернокислой меди.
Отметьте в какой цвет окрашивается белок.
Ксантопротеиновая реакция.
В пробирку налейте 2 мл раствора яичного белка и прибавьте осторожно несколько капель концентрированной азотной кислоты, затем смесь нагрейте.
Отметьте цвет образовавшегося осадка. Укажите, содержание каких остатков аминокислот можно обнаружить в белках этой реакцией.
Задания.
1. Что такое белки?
2. Опишите физические и химические свойства белков.
3. Что такое денатурация белка? Чем она может быть вызвана?
4. Какие качественные реакции на белки вы знаете? Опишите их выполнение и визуальный эффект.
5. Охарактеризуйте функции белков в организме.
|
|
|


