 |
Электролиз растворов и расплавов.
|
|
|
|
Электролиз – совокупность ОВР, протекающих при пропускании постоянного электрического тока через раствор или расплав электролита.
Электролиз осуществляется в электролизёрах. Катод присоединяется к отрицательному полюсу, анод – к положительному.
На катоде идёт процесс восстановления, а на аноде – окисления. Полярность электродов при электролизе противоположна их полярности в гальваническом элементе. Электролиз и ГЭ – противоположные процессы (обратные).
Процессы при электролизе зависят от:
1. Состава электролита;
2. Температуры электролита;
3. Материалов, из которых сделаны электроды;
4. Плотности тока;
5. Состояния поверхности электродов.
Расплав NaCl:



 ,
,  – перенапряжение.
– перенапряжение.

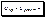
Электролиз раствора NaCl:


№14.
Последовательность электродных процессов на аноде и катоде при электролизе растворов.
При электролизе на катоде в первую очередь восстанавливаются сильные окислители с наибольшим потенциалом.

 (с учётом перенапряжения).
(с учётом перенапряжения).
Если катионы металла находятся в I гр., то восстанавливается вода:
 ;
;
Если катионы металла находятся во II гр., то на катоде происходит одновременное восстановление катионов металла и воды:


Если катион металла находится в III гр., то происходит его восстановление:

Если кислая среда:


1)  ;
;
2)  ;
;
3)  ;
;
4) кислородосодержащие кислотные остатки при электролизе на аноде не окисляются.
Схемы электролиза растворов и расплавов с инертными электродами.
Анод:
· растворимый:  и т.д.
и т.д.
· нерастворимый (инертный): графит, золото, платина и т.д.
При электролизе с активным анодом происходит его окисление, т.к. потенциал металла меньше чем потенциал аниона электролита.
Электролиз AgCl.
|
|
|



Водный раствор AgCl.

 (окисление анода).
(окисление анода).
№16.
Законы Фарадея. Выход по току.
I Закон Фарадея: “Массы веществ, выделяющиеся на электродах при электролизе пропорциональны количеству электричества, прошедшего через электролит.”
 , Кл – количество электричества.
, Кл – количество электричества.
II Закон Фарадея: “При пропускании одного и того же количества электричества через электролиты разных веществ массы выделившихся веществ пропорциональны из молярным массам эквивалентов”
 , I – ток,
, I – ток,  – время.
– время.
 ;
;  ;
; 

 ;
; 

Выход по току равен отношению массы вещества, которая выделилась практически к теоретическому расчёту.

№17.
Общие свойства металлов.
1. Взаимодействие с элементарными окислителями.  ,
,  ,
,  ,
, 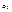 и т.д.
и т.д.
 ,
,  ,
,
 (гидрид),
(гидрид),
 .
.
2. Взаимодействие с водой. 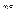


3. Взаимодействие с солями.
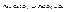
4. Взаимодействие с кислотами.
 ,
,
 ,
,
 .
.
 ,
,
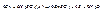 ,
,
 ,
,
зависит от концентрации кислоты
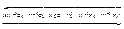
зависит от активности восстановителя

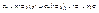
Концентрированная азотная кислота не действует на Fe, Cr, Al, платину, золото, т.к. происходит пассивация металла.
5. Со щелочами реагируют только амфотерные Ме: Cr, Al, Be,Ga, Zn и т.д.
 ,
,
 – цинковая кислота,
– цинковая кислота,
 ,
,
тетрагидроксоцинкат натрия
 ,
,
 .
.
№18.
Способы получения металлов. Пирометаллургические процессы.
Металлы с малой химической активностьювстречаются в природе в свободном состоянии (золото, платина, серебро и т.д.), а остальные металлы получают из руд.
Руды:
· Оксидные ( – бокситная руда),
– бокситная руда),
· Карбонатные ( – магнуит)
– магнуит)
· Силикатные ( – ортоклаз)
– ортоклаз)
· Галидные ( – поваренная соль)
– поваренная соль)
· Сульфидные ( – цинковая обманка)
– цинковая обманка)
Процесс получения металла сводится к процессу восстановления катионов металла до свободного состояния.

Металлургические процессы:
· Пирометаллургические (при  ),
),
· Гидрометаллургические (в растворах).
Пирометаллургические процессы подразделяются на:
1. Карботермия (С, СО):
 ,
,
 .
.
2. Восстановление водородом:
 .
.
3. Металлотермия:
|
|
|
 (алюмотермия).
(алюмотермия).
4. Термическая диссоциация:
 .
.
5. Электролиз расплавов.
Расплав  .
.
 ,
,
 .
.
№19.
|
|
|


