 |
Всероссийская олимпиада школьников по химии 2003–2004 учебного года
|
|
|
|
Областной тур
Условия заданий теоретического тура
ДЕСЯТЫЙ КЛАСС
Задача 10-1. Навеску минерала германита массой 1,956 г обожгли на воздухе, получив газ и твердый остаток, имеющий массу 1,716 г. Газбыл количественно поглощен 160 мл 0,05М раствора перманганата калия, при этом раствор обесцветился. Другую навеску этого минерала массой 1,956 г обработали кипящей азотной кислотой и разбавили, получив при этом голубой раствор и белый осадок массой 0,523 г. В состав минерала входят три элемента.
1. Определите формулу минерала.
2. Напишите уравнения описанных в задаче реакций.
3. Кто и когда открыл германий?
Задача 10-2. Имеется углеводород С6Н12, который:
а) легко реагирует с бромом, особенно в присутствии бромида железа (III);
б) легко присоединяет иодоводород;
в) гидрируется на никелевом катализаторе с образованием 3-метилпентана;
г) не реагирует на холоду с раствором перманганата калия.
1. Определите углеводород.
2. Напишите уравнения реакций а, б, в.
3. Напишите графические формулы и названия соединений, получающихся в реакциях а, б, в.
Задача 10-3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, определите неизвестные вещества:

Задача 10-4. Слили раствор, содержащий 20 г гидроксида натрия, и раствор, содержащий 29,4 г серной кислоты. После окончания реакции полученный раствор испарили при температуре, не превышающей 32°С, и получили твердый остаток А. Этот остаток прокалили при температуре <500°С, и его масса уменьшилась на 49,5% (остаток Б). Остаток Б прокалили при температуре >600°С, и потеря массы составила 4 г. Определите массу и состав остатков А и Б. Напишите уравнения всех реакций.
|
|
|
Задача 10-5. На схеме представлены превращения соединений, содержащих в своем составе серу:

Определите неизвестные вещества и напишите уравнения реакций, если:
– окисление серы происходит в присутствии платины как катализатора;
– в результате электролиза концентрированного раствора А образуется кислота Е, гидролиз которой дает кислоты А и D;
– E, D, F – сильные окислители;
– при нейтрализации Е образуется малорастворимая соль, нагревание которой, помимо других продуктов, дает В и соль кислоты А;
– С присоединяет пентафторид сурьмы с образованием одной из самых сильных кислот G;
– превращение F в В происходит при температуре 600°С.
Задача 10-6. При полном сгорании 12,84 г вещества В образовалось 8,1 л углекислого газа (объем измерен при температуре 25°С и давлении 110 кПа), 2,16 г воды и 8,28 г карбоната калия. Вещество В можно получить щелочным гидролизом препарата А, широко используемого в медицине. В 35,55 мг вещества В содержится 1020 молекул.
1. Определите формулы веществ А и В.
2. Изобразите графические формулы веществ А и В.
3. Какое тривиальное название имеет препарат А и для каких целей его назначают пациентам медики?
4. Напишите уравнение реакции получения В из А.
Всероссийская олимпиада школьников по химии 2004–2005 учебного года. Областной тур
Условия заданий теоретического тура
ДЕСЯТЫЙ КЛАСС
Задача 10-1. «Лунный элемент»
Э был открыт в 1817 г. шведским химиком Берцелиусом, он же и предложил его название. Э является сильным ядом, действующим при поступлении в организм подобно мышьяку. В чистом виде Э – твердое вещество, обладающее серым цветом с металлическим отсветом… Э энергично взаимодействует с фтором, при нагревании с хлором, кислородом. При взаимодействии Э с кислородом можно получить только один оксид, белый, твердый при комнатной температуре ЭО2. Кислота, образованная Э, водородом и кислородом (w(Э) = 0,545), способна растворять золото. Э своих минералов практически не образует, в природе сопутствует сере. (Бердоносов С. С., Жиров А. И. Справочник школьников по неорганической химии. – М., 1997).
|
|
|
1. Назовите элемент Э. Ответ обоснуйте.
2. Напишите уравнения реакций Э с фтором, хлором, кислородом.
3. Установите формулу кислоты и напишите уравнение реакции ее с золотом.
4. Э образует с серой соединение под названием сульсен, которое используют в медицине. Какова может быть формула этого соединения?
Задача 10-2. В книге «Химические реактивы, их приготовление, свойства, испытание и употребление» (составитель А. И. Коренблит, Москва, 1902) описано лабораторное получение вещества Х:
«Для лабораторного приготовления нужно брать для сухой перегонки не слишком большое количество уксуснокальциевой соли, предварительно хорошо высушенной, после непродолжительного прокаливания начинает гнаться Х, собирать его следует в хорошо охлаждаемый льдом приемник. Реакция получения Х протекает довольно правильно по уравнению (СН3СОО)2Са = Х + Y.
Первоначальная очистка полученного таким образом Х должна заключаться в перегонке его с содой для нейтрализации … кислоты (1). Дальнейшая очистка производится перегонкой Х с небольшим количеством двухромовокалиевой соли (2) для окисления некоторых побочных продуктов.
…Если необходимо иметь возможно более чистый препарат, то пользуются способностью Х давать с сернистокислым натрием (3) или калием кристаллическое соединение.
Свойства. Бесцветная, легкоподвижная жидкость нейтральной реакции, своеобразного приятного эфирного запаха, жгучая на вкус, горит светящимся пламенем. Растворяется в спирте, эфире, хлороформе и воде, отличный растворитель для многих органических соединений (смол, жиров и др.). Ткип = 56,3°, уд. в. 0,800».
1. Установите формулы Х и Y, если известно, что Y – твердое вещество, встречающееся в природе в виде минерала, при действии на который соляной кислоты выделяется газ без цвета и без запаха.
2. Каково название Х. Приведите хотя бы одно название минерала или горной породы, содержащих Y.
3. Напишите уравнение реакции разложения уксуснокальциевой соли.
4. Напишите формулы веществ 1, 2 и 3.
|
|
|
5. Напишите уравнение реакции Х с сернистокислым калием.
Задача 10-3. Приготовление… Горькая или английская соль получается растворением магнезита в серной кислоте (1). Раствор процеживается, упаривается до 40°С и подвергается кристаллизации.
Свойства… Водные растворы показывают среднюю реакцию. Дает с сернокислыми солями щелочных металлов двойные соли (2). При 132° теряется … паев …, последний пай выделяется только при 240°. Обладает слабительными свойствами и горьким вкусом…
Испытание. Раствор горькой соли, смешанный с избытком хлористого аммония и небольшим количеством аммиака должен давать от прибавления фосфорнокислого натрия белый кристаллический осадок (Y). Азотнокислый барий должен давать в водных растворах английской соли белый осадок (Х), нерастворимый в кислотах. (Химические реактивы, их приготовление, свойства, испытание и употребление. – М., 1902).
1. Установите состав английской соли, если известно, что при 132° теряется 44% по массе, а масса твердого остатка после прокаливания при 240° составляет 48,8% от исходной массы соли.
2. Напишите уравнения реакций 1 и 2.
3. Сколько паев и какого вещества должно быть написано вместо пропусков в тексте?
4. Каков состав осадка Y и Х?
Задача 10-4. Ниже приведена схема превращений металла Х. Определите этот элемент, продукты В–F и напишите уравнения всех химических реакций.
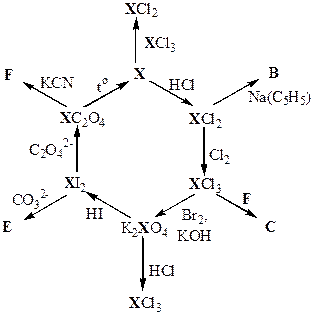
Задача 10-5. Соединение А (формула С7Н6О2) плохо растворяется в воде, но хорошо растворяется в водном растворе гидроксида натрия с образованием соли Б (формула С7Н5О2Na). В результате взаимодействия соли Б с бромной водой образуется соединение В, в котором массовая доля брома составляет 54,054%. Восстановлением 12,2 г соединения А водородом на платиновом катализаторе при 20°С получено 10,8 г соединения Г.
1. Установите возможные структурные формулы соединений А, Б, В и Г.
2. Напишите уравнения реакций.
3. Определите выход в реакции получения вещества Г.
Задача 10-6. Для устойчивого горения пиротехнической смеси без доступа воздуха необходимо, чтобы на 1 г этой смеси исходных веществ выделилось не менее 1,5 кДж теплоты.
|
|
|
Энтальпия сгорания угля равна –394 кДж/моль (энтальпия DН равна, но противоположна по знаку тепловому эффекту реакции).
КСlO3 = КСl + 1,5О2 DН = –48 кДж/моль
Вычислите минимальную массу угля (допустимо считать его чистым углеродом), которую нужно добавить к 100 г хлората калия для устойчивого горения смеси.
|
|
|


