 |
Задача 10-5. (Автор – Тюльков И.А.)
|
|
|
|
Кристаллическая решетка – математическая абстракция – регулярное периодическое расположение точек (узлов) в пространстве.
Большинство твердых веществ находятся в кристаллическом состоянии. Кристаллы – твердые вещества, характеризующиеся упорядоченным расположением в пространстве ионов, атомов или молекул. Расположение атомов, молекул или ионов в кристалле можно описывать на основе представления о кристаллической решетке.
Кристаллическая решетка построена из повторяющихся одинаковых структурных единиц – элементарных ячеек (ЭЯ), индивидуальных для каждого кристалла.
Элементарная ячейка кристаллической решетки хлорида натрия представлена на рис. 1. Каждый ион натрия окружен 6 хлорид-ионами, а каждый хлорид-ион окружен 6 ионами натрия, т. е. KЧ(Na+) = КЧ(Сl–) = 6.
 Рис. 1.
Рис. 1.
Имеется прямая связь между ЭЯ и стехиометрией соединения. Известно, что стехиометрическая формула хлорида натрия – NaCl. Следовательно, в ЭЯ соотношение числа атомов натрия и хлора должно быть 1:1.
На первый взгляд это не так. Для расчета стехиометрического состава по ЭЯ необходимо учитывать, что в кристаллической решетке много повторяющихся ЭЯ, соприкасающихся гранями, ребрами и вершинами. Поэтому:
– ион в вершине куба обобществляется восьмью ЭЯ;
– ион на грани куба обобществляется четырьмя ЭЯ;
– ион в центре грани куба обобществляется двумя ЭЯ;
– ион в центре куба принадлежит только данной ЭЯ.
В данной кристаллической решетке:
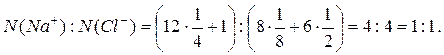
1. Какие из перечисленных веществ имеют кристаллическое строение: железо, белый фосфор, сульфат бария, стекло, графит?
2. Определите координационные числа Cs+ и Сl– в элементарной ячейке кристаллической решетки хлорида цезия (рис. 2).
|
|
|
 Рис. 2.
Рис. 2.
3. Покажите, что отношение Cs:Cl равно 1:1.
Задача 10-6. (Автор – Теренин В.И.)
Соединение А (формула С7Н6О2) плохо растворяется в воде, но хорошо растворяется в водном растворе гидроксида натрия с образованием соли Б (формула C7H5O2Na). В результате взаимодействия соли Б с бромной водой было выделено соединение В, в котором массовая доля брома составляет 64,0%. Восстановлением 6,1 г соединения А водородом на платиновом катализаторе при 20°С получено 5,4 г соединения Г.
1. Установите формулу соединения А. Решение обоснуйте.
2. Напишите уравнение реакции А со щелочью и укажите вещество Б.
3. Напишите уравнение реакции вещества Б с бромной водой в общем виде и установите формулу вещества В.
4. Определите выход в реакции получения вещества Г.
5. Изобразите структурные формулы веществ А, Б, В и Г.
III (областной) этап Всероссийской олимпиады школьников по химии 2006 – 2007 год 10 КЛАСС
Условия задач
Задача 10–1
Даны условия двух задач:
Задача 1. После растворения смеси хлорида бария и сульфата натрия в воде, масса образовавшегося осадка оказалась в 3 раза меньше массы солей в фильтрате (получившемся растворе). Определите массовые доли солей в исходной смеси, если известно, что в фильтрате отсутствуют ионы бария.
Задача 2. После растворения смеси хлорида бария и сульфата натрия в воде, масса образовавшегося осадка оказалась в 3 раза больше массы солей в фильтрате (получившемся растворе). Определите массовые доли солей в исходной смеси, если известно, что в фильтрате отсутствуют ионы бария.
1. Решите эти задачи.
2. Проанализируйте обе задачи на химическую корректность.
3. Сделайте соответствующие выводы.
Задача 10–2
К водным растворам хлоридов калия, магния, кальция, алюминия, меди (II) и железа (III) прилили водный раствор карбоната натрия. В пяти пробирках наблюдалось выпадение осадка, в трех – выделение газа.
|
|
|
1. Напишите уравнения происходящих реакций.
2. В каком случае при кипячении маточного раствора (раствора полученного после отделения осадка) происходит выделение дополнительного количества газа и выпадение осадка другого состава, чем первоначальный?
3. Что изменится при замене среднего карбоната калия на кислый?
4. На каких свойствах основано использование питьевой соды в кулинарии, в медицине?
5. Можно ли использовать для полоскания горла раствор питьевой соды, растворенной в воде, нагретой до температуры кипения?
Задача 10–3
1. Вычислите стандартную теплоту сгорания нафталина, если стандартные теплоты образования нафталина, воды и оксида углерода (IV) равны соответственно: –75,8; 285,8; 393,5 кДж/моль. Молекула нафталина состоит из двух конденсированных бензольных ядер.
2. Какое количество теплоты выделится при сгорании 1 г нафталина в калориметрической бомбе?
3. На сколько градусов можно нагреть 1,5 л воды теплотой, выделившейся при сгорании 1 г нафталина (удельная теплоемкость воды 4,184 Дж/г×К)?
4. Оцените, до какого значения повысится температура 1,5 л воды, если ей передать все количество теплоты, выделившееся при сгорании 20 г нафталина, при стандартных условиях.
Задача 10–4
При радикальном хлорировании алканов скорости замещения атомов водорода при первичном, вторичном и третичном атоме углерода не зависят от длины и структуры углеродного скелета.
Радикальное хлорирование может быть осуществлено при помощи сульфурилхлорида (SO2Cl2).
1. По представленному ниже составу продуктов заполните таблицу и рассчитайте соотношение скоростей реакций замещения водорода на галоген у первичного (I), вторичного (II) и третичного (III) атомов углерода.
(CH3)2CH–CH3 + ClSO2Cl  (CH3)3CCl + (CH3)2CHCH2Cl
(CH3)3CCl + (CH3)2CHCH2Cl
31% 69%
CH3CH2CH2CH2CH3 + ClSO2Cl 
CH3CH2CH2CHClCH3 + CH3CH2CH2CH2CH2Cl + CH3CH2CHClCH2CH3
48% 28% 24%
Таблица
| Относительные количества хлорзамещенных продуктов | Статистический фактор (количество атомов водорода при соответствующем углероде) | Тип атома углерода (первичный, вторичный, третичный) |
2. Напишите уравнение реакции радикального хлорирования 2,4-диметилпентана и предскажите относительные количества монохлорзамещенных продуктов (в %).
|
|
|
Задача 10–5
В своих популярных Рождественских лекциях М. Фарадей для идентификации продуктов горения свечи использовал «… химическое вещество, открытое сэром Гемфри Деви; оно очень энергично действует на воду, и это воздействие будет служить нам для обнаружения воды. Вещество это называется ……., достаточно взять маленький кусочек его и бросить в чашку с водой; как только оно попадет на воду, так сейчас же вспыхивает…». Более ста лет назад И. Либих, наблюдая роль ……. И фосфора в растениях, сказал: «Без этих двух элементов не может быть плодородия наших полей».
1. Какое вещество открыл сэр Г. Деви? Напишите уравнение реакции этого вещества с водой.
2. Из какого соединения и каким образом выделил Г. Деви это вещество? Напишите уравнение реакции.
3. В виде каких соединений вещество, открытое Г. Деви, встречается в природе и где, по Вашему мнению, в нашей стране находятся основные залежи его минералов, имеющие промышленное значение? Какой может быть окраска этих минералов и почему?
4. Содержание этого питательного элемента определяют в расчете на условное содержание его оксида. Определите, выше какого значения не может быть условное содержание оксида в хлориде этого вещества (элемента).
5. Напишите уравнение реакции этого вещества с газообразным и жидким аммиаком.
|
|
|


