 |
Методы определения количества эритроцитов
|
|
|
|
1) При помощи камеры Горяева. Для уменьшения концентрации форменных элементов и создания удобной для подсчета их концентрации кровь предварительно разводится 3,5% раствором NaCl. На участок камеры, где нанесены сетки, кладут обезжиренное покровное стекло. Каплю исследуемой жидкости пипеткой помещают перед щелью, образованной покровным стеклом и пластинкой камеры Горяева с нанесенной сеткой. Капля должна заполнить камеру самотеком (под действием капиллярных сил). Эритроциты считают в пяти больших квадратах, состоящих из 16 малых (всего 80).
2)Фотометрический метод. Принцип метода основан на фотометрическом измерении степени погашения света определенных длин волн взвесью эритроцитов. Процент задержанного света прямо пропорционален числу (концентрации) эритроцитов,
3) Электронно-автоматический метод. Это метод подсчета эритроцитов с помощью автоматического или полуавтоматического анализатора.
7. Реакция оседания эритроцитов (РОЭ). Ее механизм и значение.
Плотность эритроцитов выше, чем плазмы (1,095 и 1,030 соответственно), поэтому при отстаивании в пробирке крови, предохраненной от свертывания, эритроциты медленно оседают на дно. В сосудистой системе эритроциты не оседают. Это связано с тем, что они имеют одинаковый отрицательный заряд и отталкиваются друг от друга. Такой же отрицательный заряд имеют стенки сосудов. Способствуют взвешенному состоянию эритроцитов и низкомолекулярные белки плазмы – альбумины. Оседание эритроцитов вне организма обусловлено потерей ими заряда и образованием скоплений – агрегатов.
Скорость оседания эритроцитов (СОЭ) зависит от вида животных, возраста, физиологического состояния. Так, у взрослого крупного рогатого скота и овец СОЭ очень низкая, составляет 0,7 мм, у птицы — 4,0, у свиней — 8,0, у лошадей — очень высокая, 64 мм за первый час.
|
|
|
Величина СОЭ зависит от числа эритроцитов, их размера и особенно от белкового состава плазмы. Она повышается при снижении содержания альбуминов и увеличении фибриногена, церулоплазмина, липопротеинов, иммуноглобулинов. При сдвиге альбуминово-глобулинового индекса СОЭ соответственно меняется.
У людей в норме скорость оседания эритроцитов (СОЭ) у мужчин 2-10 мм/час, у женщин 2-15 мм/час. Она возрастает при беременности. Особенно СОЭ повышается при различных заболеваниях. Например, при анемии она возрастает из-за снижения вязкости крови. СОЭ также увеличивается при инфекционных воспалительных заболеваниях, аллергических реакциях и особенно злокачественных опухолях. В этом случае ее возрастание объясняется накоплением в крови грубодисперсных глобулинов – агломеринов и фибриногена. Выдвинуто 2 теории, объясняющие повышение СОЭ:
1. Электрохимическая. Она связывает оседание эритроцитов с нейтрализацией их отрицательного заряда агломеринами.
2. Теория лабильности коллоидов. Объясняет агрегацию и оседание эритроцитов накоплением в крови агломеринов и фибриногена. Они являются неустойчивыми коллоидами, поэтому осаждаются на эритроцитах. Клейкость их оболочки увеличивается, и они склеиваются в агрегаты.
После физических нагрузок РОЭ замедляется.
Значение имеет не только абсолютная СОЭ, но и её динамика при развитии патологического процесса.
8. Гемоглобин, его структура и свойства. Количество гемоглобина у животных разных видов, пола и возраста. Методы определения количества гемоглобина в крови.
Гемоглобин. Около 34% общей и 90% сухой массы эритроцита приходится на долю дыхательного пигмента — гемоглобина (НЬ). Это вещество по химической структуре относится к хромопротеидам. Оно способно легко связывать и отщеплять кислород, превращаясь соответственно в окисленный (НbО2) и восстановленный гемоглобин (Нb). Среднее содержание гемоглобина в крови сельскохозяйственных животных (этот показатель определяют колориметрическим методом после разрушения эритроцитов) составляет 90—100 г в литре крови. Гемоглобин представляет собой глобулярный белок, полипептидные цепи которого свернуты в компактную глобулу. Такая конформация способствует выполнению гемоглобином его основной функции — связывания и переноса кислорода. Биосинтез – в костном мозге и эритробластах.
|
|
|
Молекулярная масса гемоглобина — 64500, он содержит четыре полипептидные цепи (две aльфа-цепи и две бета-цепи) и четыре простетические группы гема. В геме атом железа находится в закисной форме. Полипептидная aльфа-цепь содержит 141 аминокислотный остаток, бета-цепь — 146 остатков. Всю белковую часть молекулы гемоглобина называют также глобином.
Если структура гема в гемоглобине у разных животных одинакова, то глобин (его полипептидные цепи) имеет значительные разнообразия в последовательности и содержании отдельных аминокислот. Различают две разновидности гемоглобина — тип А у взрослых животных и тип F у плода. Они различаются по структуре полипептидных цепей. Фетальный гемоглобин обладает более высоким сродством к кислороду, чем гемоглобин взрослых, что создает оптимальные условия для перехода кислорода из крови матери в кровь плода. Окисление F-гемоглобина происходит за счет гемоглобина А матери, который находится в кровеносной системе плаценты, по другую сторону трансплацентарного барьера.
При присоединении кислорода к железу гема образуется окисленная форма гемоглобина — оксигемоглобин (НbО2). Присоединение кислорода к одному гему облегчает его присоединение к другим гемам той же молекулы гемоглобина. Этот эффект, называемый кооперативным, способствует увеличению количества транспортируемого кислорода. Помимо кислорода, гемоглобин способен связывать также Н + (буферная емкость НЬ) и СО2 (карбаматная связь).
Кроме оксигемоглобина и карбогемоглобина, в организме могут образовываться
и патологические соединения — карбоксигемоглобин (НbСО) и метгемоглобин (МtHb). Поскольку гемоглобин присоединяет угарный газ в 150—200 раз активнее, чем кислород, даже при низкой концентрации этого соединения в воздухе (0,1 %) около 80 % гемоглобина превращается в НЬСО, который не способен присоединять кислород.
|
|
|
Метгемоглобин образуется при действии на кровь сильных окислителей (феррицианида, перманганата калия, бертолетовой соли и др.). При этом железо гема переходит в трехвалентную форму и образует стойкое, нераспадающееся соединение с кислородом. Транспорт кислорода нарушается.
У сельскохозяйственных животных содержание метгемоглобина в крови возрастает при отравлении нитратами, что связано с поеданием зеленых кормов или корнеплодов, выращенных при высоких дозах азотистых удобрений. Кровь при избытке метгемоглобина приобретает коричневый оттенок.

У самцов содержание гемоглобина немного выше, чем у самок. У беременных самок этот показатель ещё сильнее понижается. У новорождённых детёнышей до возраста 2 недель очень высокий показатель гемоглобина, затем, к месяцу, он сильно понижается – до уровня, более низкого, чем у взрослых животных. С возрастом количество гемоглобина увеличивается, достигая средних значений для данного вида. У старых животных этот показатель может снижаться.
10. Миоглобин, его структура, роль и количество у разных видов животных.
Миоглобин - это сложный белок мышечной ткани, связывающий переносимый кровью молекулярный кислород и передающий его окислительным системам волокон. Также его функция заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода. Молекула миоглобина состоит из одной полипептидной цепи (Апомиоглобин - белковая часть миоглобина) и гема. По пространственной структуре миоглобин напоминает альфа-цепь гемоглобина. Молекулярная масса — 17500.
Миоглобин обладает большим сродством к кислороду, чем гемоглобин, и может связывать до 15 % общего количества кислорода в организме. Высвобождение О2 из миоглобина происходит при сокращении работающих мышц, когда сжимаются капилляры и давление кислорода резко падает. Миоглобин скелетных мышц и миоглобин миокарда (сердечной мышцы) слегка различны по аминокислотной последовательности. В практической медицине этот факт используется для определения диагноза инфаркта миокарда по появлению специфического «сердечного» изотипа миоглобина (равно как и «сердечных» изотипов некоторых мышечных ферментов) в крови. В нормальных условиях, в отсутствие повреждения или воспаления мышечной ткани, миоглобин в кровь не попадает.
|
|
|
Подобно гемоглобину, миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови: крупные молекулы миоглобина могут закупоривать канальцы почек и приводить к их некрозу; конкурируя с гемоглобином эритроцитов за связывание с кислородом в лёгких и не выполняя функцию передачи кислорода тканям, свободный миоглобин ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии.
В разных мышцах одного и того же животного неодинаково и содержание миоглобина: наиболее богаты им те мышцы, которые несут большую нагрузку при движении. Так, в мышцах конечностей оно выше, чем в мышцах брюшной стенки и спины. У птиц оно более значительно в больших грудных мышцах, чем в малых с меньшей нагрузкой при полете. У крота оно особенно велико в мышцах предплечья. В животном мире происходит то же самое: в мышцах у более подвижных животных больше миоглобина, чем у менее подвижных. В больших количествах (до 7 % массы) (эти показатели примерно в 10 раз выше, чем у наземных млекопитающих) миоглобин содержится в мышцах морских млекопитающих — дельфинов, тюленей, моржей, способных к длительному пребыванию под водой.
Количество миоглобина в мускулатуре ныряющих животных может быть очень большим. Так, у хохлатого пингвина концентрация миоглобина в грудных мышцах составляет в среднем 3700 мг%, а общая обеспеченность организма достигает 10,4 г миоглобина на 1 кг массы тела. У пингвина Адели концентрация миоглобина 2800—3200 мг%, у антарктического пингвина — 4200—4600 мг%, а у наземных птиц — порядка 300—400 мг% К этому можно добавить, что у диких птиц содержание миоглобина выше, чем у домашних; у зайца выше, чем у кролика; у дикого козла выше, чем у домашнего; у охотничьих собак выше, чем у домашних.
11. Лейкоциты. Количество лейкоцитов. Подсчет количества лейкоцитов.
Лейкоциты, или белые кровяные тельца, — бесцветные клетки, имеющие ядро и протоплазму специфической структуры и не содержащие гемоглобина. Происходят из одной ≪материнской≫ стволовой клетки костного мозга, дающей начало элементам моноцитарного, гранулоцитарного и лимфоцитарного ряда. Первые две группы — моноциты и гранулоциты (базофилы, нейтрофилы и эозинофилы) — образуются и дифференцируются в костном мозгу, третья группа (лимфоциты) образуется в лимфатических узлах, селезенке и тимусе из первичных стволовых клеток костного мозга и дифференцируются в одном из лимфоидных органов. Зернистые формы - базофилы, эозинофилы и нейтрофилы — полиморфноядерные клетки с зернистой протоплазмой, способной окрашиваться различными красителями. Нейтрофилы по возрасту могут быть юными, палочкоядерными, сегментоядерными. Незернистые формы - моноциты и лимфоциты имеют крупное ядро и относительно небольшое количество незернистой протоплазмы.
|
|
|
Все формы лейкоцитов в той или иной мере обладают способностью к амебоидному движению и могут проникать через стенку кровеносных сосудов. Больше половины
лейкоцитов находится за пределами сосудистого русла, в межклеточном пространстве,
примерно треть — в костном мозгу. Лейкоциты способны окружать инородные тела,
захватывать их в цитоплазму и переваривать с участием лизосом. Это явление носит
название фагоцитоза. В лейкоцитах содержатся соответствующие ферменты — протеазы,
пептидазы, липазы, дезоксирибонуклеазы.
В крови лейкоцитов примерно в 1000 раз меньше, чем эритроцитов. Значительное и стойкое повышение числа лейкоцитов называется лейкоцитозом, уменьшение — лейкопенией. Лейкоцитоз может быть физиологическим (после приема корма, при мышечной работе, при беременности) и патологическим (при инфекционных болезнях, воспалительных процессах). Продолжительность жизни большинства лейкоцитов — от нескольких часов до нескольких дней.
Подсчет количества лейкоцитов крови может быть произведен при помощи камеры Горяева. Принцип методааналогичен таковому подсчету эритроцитов. Для уменьшения концентрации форменных элементов и создания удобной для подсчета их концентрации кровь предварительно разводится 3,5% раствором NaCl. На участок камеры, где нанесены сетки, кладут обезжиренное покровное стекло. Каплю исследуемой жидкости пипеткой помещают перед щелью, образованной покровным стеклом и пластинкой камеры Горяева с нанесенной сеткой. Капля должна заполнить камеру самотеком (под действием капиллярных сил). Эритроциты считают в пяти больших квадратах, состоящих из 16 малых (всего 80).
12. Виды лейкоцитов. Лейкоцитарная формула. Основные функции отдельных форм лейкоцитов.
Зернистые формы - базофилы, эозинофилы и нейтрофилы — полиморфноядерные клетки с зернистой протоплазмой, способной окрашиваться различными красителями. Незернистые формы - моноциты и лимфоциты имеют крупное ядро и относительно небольшое количество незернистой протоплазмы.
Все виды лейкоцитов участвуют в защитных реакциях организма, но каждый вид осуществляет это особым способом.
Нейтрофилы (микрофаги) составляют вместе с лимфоцитами основную массу белых кровяных телец. По возрасту они могут быть юные, палочкоядерные (незрелые формы) и сегментоядерные (зрелые формы). Гранулы цитоплазмы нейтрофилов по отношению к красителям нейтральны. Нейтрофилы фагоцитируют бактерии и продукты распада тканей
и разрушают их ферментами. Гной состоит главным образом из нейтрофилов и их остатков. Нейтрофилы оказывают также противовирусное действие, вырабатывая особый белок — интерферон.
Базофи лы — самая многочисленная группа гранулоцитов. Гранулы их цитоплазмы окрашиваются основными красками в синие или фиолетовые тона. Базофилы синтезируют противосвертывающее вещество — гепарин, а также гистамин, участвующий в воспалительных реакциях по месту внедрения микробов. Предполагается участие базофилов в аллергических реакциях (гиперемия кожи, появление сыпи, спазм бронхов).
Эозинофилы имеют цитоплазму, воспринимающую кислые красители красно-розового цвета. Участвуют в обезвреживании токсинов белкового происхождения. Содержат фермент гистаминазу, разрушающий гистамин и снижающий местную воспалительную реакцию.
Моноциты — крупные клетки (диаметр 12—20 мкм), не содержащие цитоплазматических гранул. Обладают хорошо выраженной фагоцитарной и бактерицидной активностью. Фагоцитируют микробы, погибшие лейкоциты, поврежденные клетки тканей, очищая очаг воспаления. Из крови переходят в окружающие ткани, где дозревают, превращаясь в неподвижные клетки — тканевые макрофаги. Эти клетки образуют ограничивающий валик вокруг инородных тел, не разрушаемых ферментами.
Лимфоциты составляют значительную (а у жвачных животных, птиц и рыб — преобладающую) часть лейкоцитов. Соотношение их с гранулоцитами меняется в процессе онтогенеза животного. Образуются в лимфатических узлах, глоточных миндалинах — пейеровых бляшках кишечника, слепых отростках, селезенке, тимусе, фабрициевой бурсе (у птиц). Если все остальные элементы белой крови несут в основном неспецифические защитные механизмы (фагоцитоз, выработка интерферона, лизоцима, пропердина, гистамина и других биологически активных веществ, содержащихся в жидкостях организма), то лимфоциты играют основную роль в специфических защитных реакциях — формировании клеточного и гуморального иммунитета.
Процентное соотношение отдельных форм лейкоцитов называют лейкоцитарной формулой, или лейкограммой.

13. Тромбоциты, их количество, строение и функции.
Тромбоциты, или кровяные пластинки, представляют собой плоские безъядерные (кроме птиц, рыб и рептилий) клетки неправильной округлой формы, диаметром 2—4 мкм, толщиной 0,5—0,7 мкм. Образуются в красном костном мозгу из стволовой клетки, проходя через стадии мегокариобласта и мегакариоцита., затем поступают в кровь. В крови взрослых сельскохозяйственных животных их содержится 200—450 тыс., в крови птиц — 50 тыс. в 1 мкл. Из этого числа 15% обновляется ежедневно. Средняя продолжительность жизни составляет 9–10 дней. Тромбоциты хрупки, легко разрушаются. В гранулах протоплазмы тромбоцитов содержится липопротеин (тромбоцитарный фактор), ферменты метаболизма, серотонин, гистамин, адреналин, запасы АТФ.
Функции тромбоцитов
1. Остановка кровотечения (гемостаз) при ранении мелких сосудов происходит у животных в течение 4— 8 мин. Этот гемостаз в сосудах с низким давлением называется первичным. Он обусловлен длительным спазмом сосудов и механической закупоркой их агрегатами тромбоцитов. Прилипая к коллагеновым волокнам краев раны, тромбоциты (вследствие повышения проницаемости их мембран) выделяют АТФ и АДФ, а также сосудосуживающие вещества — адреналин, норадреналин, серотонин. Просвет поврежденного сосуда уменьшается и закрывается тромбоцитами. Под влиянием АДФ происходит агрегация тромбоцитов, которая носит обратимый характер.
Вторичный гемостаз обеспечивает плотное закрытие поврежденных сосудов тромбом. Он предохраняет от возобновления кровотечения из поврежденных мелких сосудов и является основным механизмом защиты от кровопотери при повреждении сосудов мышечного типа. При этом происходит необратимая агрегация тромбоцитов и образование кровяного сгустка (свертывание крови).
2. Свертывание крови — это цепь последовательных ферментативных
процессов, приводящих в конечном итоге к выпадению в осадок белка
плазмы — фибриногена и образованию сгустка из нитей фибрина и захваченных форменных элементов.
3. Участие в реакции заживления ран (главным образом повреждения сосудистой стенки) и воспаления, а также в неспецифических защитных реакциях (фагоцитоз небиологических инородных тел и иммунных комплексов).
4. Обеспечение нормальной функции сосудов, в частности их эндотелиальной выстилки – ангиотрофическая.
14. Современные представления о механизме свертывания крови. Три основных этапа свертывания крови.
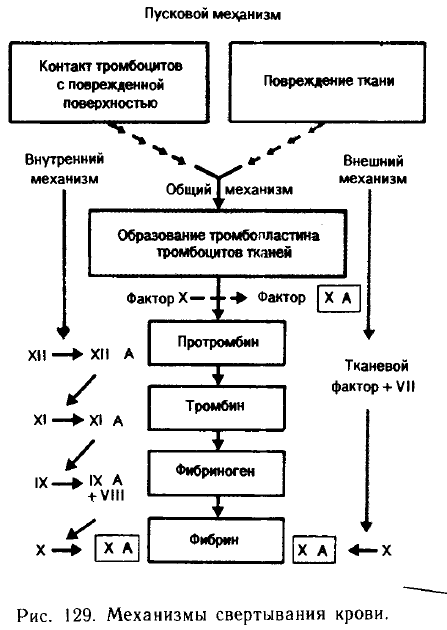
Свертывание крови — защитная реакция, предохраняющая организм от кровопотери. Это цепь последовательных ферментативных процессов, находящихся под нервно-гуморальным контролем, приводящих в конечном итоге к выпадению в осадок белка плазмы — фибриногена и образованию сгустка из нитей фибрина и захваченных форменных элементов. Основные этапы (фазы) свертывания крови сформулированы в классической схеме Шмидта— Моравица в конце XIX — начале XX вв.
Согласно этой схеме (1) исходным моментом является разрушение тромбоцитов и выделение кровяного и тканевого тромбопластина (тромбокиназы). (2) Под его воздействием плазменный белок протромбин превращается в тромбин. (3) Последний вызывает переход растворенного фибриногена в фибрин, нити которого составляют основу образовавшегося тромба, в который также входят застрявшие форменные элементы крови. Через несколько часов сгусток фибрина сжимается (ретракция) и из него выдавливается светлая жидкость — сыворотка.

15. Факторы, способствующие и препятствующие свертыванию крови в организме. Скорость свертывания крови у разных видов животных.
В крови животных содержатся многочисленные факторы, которые делят на прокоагулянты (способствующие свёртыванию) и антикоагулянты (препятствующие свёртыванию). Прокоагулянты находятся в плазме, в кровяных пластинках и эритроцитах. В циркулирующей крови они находятся в неактивной форме, их деятельность подавляется естественными антикоагулянтами (гепарин) и ингибиторами свёртывания (белок плазмы антитромбин III).

Известно 13 факторов, способствующих свертыванию крови, которые содержатся в плазме, форменных элементах и тканях. Большинство из них — проферменты.
Факторы, препятствующие свертыванию крови (ингибиторы, антикоагулянты), а также вещества, обеспечивающие растворение кровяного сгустка (факторы фибринолиза).
Активные факторы свертывания — это в основном белки, синтезируемые печенью. Их взаимодействие — это каскад процессов активации проферментов, каждый из которых необходим для следующего этапа. При этом факторы, действующие на начальных этапах, требуются в очень малых количествах. Их эффект многократно усиливается на последующих этапах.
Процесс свертывания начинается взаимодействием липидного фактора тромбоцитов или ткани с рядом факторов плазмы, в результате чего образуется тромбопластин (точнее, проявляется тромбопластиновая активность).
В зависимости от происхождения липидного фактора различают плазменный и тканевый тромбопластин. В первом случае цепь реакций обозначают как внутренний механизм, во втором — как внешний механизм. Оба механизма необходимы для нормального свертывания крови, они действуют взаимосвязанно, объединяясь на стадии активации фактора X.
Оба механизма приводят к появлению протеолитических ферментов, активизирующих
фактор X. Под воздействием этого фактора непосредственно осуществляется второй этап свертывания крови — активация протромбина и превращение его в тромбин путем отщепления концевого участка. Ускоряет этот процесс, происходящий на фосфолипидной поверхности тромбоцитов, фактор V. Свободный тромбин представляет собой протеолитический фермент, под влиянием которого фибриноген превращается в нерастворимый мономер фибрина. Последний представляет собой молекулу фибриногена, лишенную четырех пептидов в результате расщепления тромбином четырех пептидных связей между аргинином и глицином. Молекулы фибрина способны спонтанно агрегировать, образуя длинные нерастворимые нити фибрина. Возникающий при этом сгусток, вначале рыхлый и слабый, стабилизируется поперечными связями между боковыми цепями молекул в фибриновых нитях.
Следует отметить, что длительность жизни активных факторов свертывания
крови очень короткая, они быстро разводятся в кровотоке, расщепляются
ферментами, инактивируются ингибиторами. Среди последних важную роль играет белок плазмы антитромбин III, который связывает тромбин и ингибирует факторы IX, X и XI. Действие антитромбина усиливается в присутствии гепарина — полисахарида, вырабатываемого базофилами и тучными клетками. Гепарин действует как антикоагулянт, усиливая образование комплекса тромбин — антитромбин. Антикоагулянтами являются
также цитрат натрия, ацетилсалициловая кислота оксалаты, ЭДТА, связывающие ионы Са++.
16. Современные представления об иммунных свойствах крови. Виды иммунитета. Тканевый и клеточный иммунитет.
Иммунитет - это защита организма от всего, что генетически для него чужеродно: от микробов, от чужих клеток и тканей, от собственных, но измененных клеток (например, раковых клеток). Чужеродные для организма макромолекулы называют антигенами.
Лейкоциты (базофилы, эозинофилы, нейтрофилы, моноциты) отвечают за реакции неспецифического иммунитета, к которым относится фагоцитоз. Фагоцит обволакивает антиген и разрушает его с помощью белковых соединений и ферментов – лизоцима, фибропектина и других. Это приводит к уничтожению оболочек чужеродных веществ с последующим удалением. Части погибших бактерий выносятся на поверхность фагоцита – осуществляется их презентация. Это необходимо для последующего узнавания непрошенного гостя. Если подобная частица снова появится в организме, лимфоцит признает ее и быстро удалит.
Если все остальные элементы белой крови несут в основном неспецифические защитные механизмы (фагоцитоз, выработка интерферона, лизоцима, пропердина, гистамина и других биологически активных веществ, содержащихся в жидкостях организма), то лимфоциты играют основную роль в специфических защитных реакциях — ф ормировании клеточного и гуморального иммунитета.
Два основных типа иммунных ответов организма на антиген — гуморальный и к леточный. Ответ гуморального типа состоит в выработке антител, которые циркулируют в крови и специфически связываются с чужеродными организму молекулами. Иммунный ответ клеточного типа включает образование специализированных клеток, реагирующих с антигеном посредством его связывания и последующего разрушения. Клеточный иммунитет обращен в основном против клеточных антигенов — бактерий, патогенных грибов, чужеродных клеток и тканей (пересаженных или опухолевых). В случае гуморального иммунитета, защитные функции выполняют молекулы, находящиеся в плазме крови, но не клеточные элементы. В то время как в случае клеточного иммунитета защитная функция связана именно с клетками иммунной системы.
Два основных типа иммунных реакций опосредуются разными классами лимфоцитов: за гуморальный иммунитет ответственны В-лимфоциты, за клеточный — Т-лимфоциты.
Т-киллеры обладают способностью разрушать неполноценные клетки организма, вступая с ними в непосредственный контакт.
Т-хелперы стимулируют иммунный ответ: под их влиянием усиливают свою работу цитотоксические лимфоциты. Также хелперы передают информацию о присутствии в теле чужеродного белка В-лимфоцитам, которые выделяют против них защитные антитела. Наконец, хелперы оказывают стимулирующее действие на работу фагоцитов, главным образом моноцитов.
Т-супрессоры подавляют реакцию иммунитета, регулируют силу иммунного ответа, что позволяет иммунной системе сдержанно и с умеренной силой отвечать на раздражители.
В-лимфоциты при контакте с антигеном или стимуляции со стороны T-клеток трансформируются в плазматические клетки, способные к продукции антител или превращаются в B-клетки памяти.
Лимфоциты мигрируют из крови в межтканевое пространство, затем через системы малых лимфатических сосудов попадают в лимфатические узлы, снова возвращаются в грудной лимфатический проток и через него в кровяное русло. Постоянная циркуляция лимфоцитов обеспечивает их контакт с антигенами и друг с другом, а также распределение активированных Т- и В-клеток по периферическим лимфоидным тканям. Из общего количества лимфоцитов, циркулирующих в крови и лимфе, примерно 75 % приходится на долю Т-лимфоцитов, 15 % — на долю В-лимфоцитов и 10 % — на клетки, не относящиеся ни к той, ни к другой группе (нуль-клетки, или К-клетки).
Механизм иммунного ответа. До стимуляции антигеном (≪в покое≫) Т- и В-лимфоциты морфологически мало различимы. Под влиянием антигена происходят пролиферация и дифференцировка и тех и других клеток. Активированные Т-клетки трансформируются в лимфобласты, которые дают начало нескольким субпопуляциям клеток. Среди них активные Т-киллеры, Т-супрессоры, подавляющие иммунный ответ, Т- хелперы, интегрирующие иммунный ответ путем кооперации с В-лимфоцитами при выработке антител или путем стимуляции Т-киллеров. Все эти Т-клетки-партнеры обладают одинаковыми антигенными рецепторами и одинаковыми антигенами главного комплекса гистосовместимости (ГК.Г). Последние представляют собой мембранные гликопротеиды клеток, обеспечивающие их иммунологическую совместимость.
Активированные Т-лимфоциты всех популяций выделяют также растворимые факторы (лимфокины), которые регулируют проявление клеточного иммунитета (супрессию, кооперацию, приобретение специфических свойств Т-лимфоцитами) и активируют
фагоцитарную активность макрофагов. Примерами лимфокинов могут служить глюкопротеид интерлейкин, стимулирующий рост и пролиферацию Т-лимфоцитов, и белок интерферон, подавляющий размножение вирусов и одновременно усиливающий фагоцитоз. Активированные антигеном В-лимфоциты становятся затем продуцентами
антител. При первом контакте с антигеном происходит их начальная активация, или сенсибилизация. Некоторые из дочерних клеток превращаются в клетки и ммунологической памяти, другие оседают в периферических лимфатических органах. Здесь они превращаются в плазматические клетки, обладающие хорошо развитым гранулярным эндоплазматическим ретикулумом. Плазматические клетки при участии Т-хелперов начинают вырабатывать антитела, которые выделяются в плазму крови. Клетки иммунологической памяти не дают первичного иммунологического ответа, но при повторном контакте с тем же антигеном легко превращаются в клетки, секретирующие антитела.
Различают также следующие виды иммунитета:
Наследственный (видовой) иммунитет – это иммунитет, который передается по наследству, в результате чего определенный вид (животные или человек) невосприимчив к микробам, вызывающим заболевание у другого вида. Этот иммунитет неспецифичен (не направлен на определенный вид антигена) и может быть абсолютным или относительным. Абсолютный не изменяется и не утрачивается, а относительный утрачивается при воздействии неблагоприятных факторов.
Приобретенный иммунитет не передается по наследству, а приобретается каждым организмом в течение жизни. Например, после перенесения заболевания (корь) человек становится устойчивым к этому заболеванию (приобретает иммунитет к кори). Другими болезнями человек может заболеть, т.е. приобретенный иммунитет является специфическим (направлен на определенный вид антигена).
Приобретенный иммунитет может быть активным и пассивным.
Активный иммунитет вырабатывается при действии антигена на организм. В результате организм становится способным самостоятельно вырабатывать специфические антитела или клетки против этого антигена. Антитела могут долго сохраняться в организме, иногда всю жизнь (например, после кори).
Активный иммунитет может быть естественным и искусственным.
Естественный активный иммунитет вырабатывается после перенесения инфекционного заболевания, когда микробы-антигены попадают в организм естественными путями (с водой, воздухом, пищей). Такой иммунитет еще называют постинфекционным.
Искусственный активный иммунитет вырабатывается в ответ на искусственное введение микробных антигенов (вакцин). Такой иммунитет еще называют поствакцинальным.
Пассивный иммунитет возникает в организме при попадании в него уже готовых антител или лимфоцитов (они вырабатываются другим организмом). Такой иммунитет сохраняется недолго (15-20 дней), потому что "чужие" антитела разрушаются и выводятся из организма.
Пассивный иммунитет также может быть естественным и искусственным.
Естественный пассивный иммунитет возникает, когда антитела передаются от матери к плоду через плаценту. Такой иммунитет еще называют плацентарным.
Искусственный пассивный иммунитет возникает после введения лечебных сывороток (лекарственных препаратов, содержащих готовые антитела). Такой иммунитет еще называют постсывороточным. Его чаще создают для экстренного лечения инфекционных заболеваний. Если ребенку ввести сыворотку крови человека, переболевшего корью, то он становится невосприимчивым к кори.
Выделяют также такие виды иммунитета, как
- гуморальный – объясняется наличием защитных веществ (в том числе, антител) в крови, лимфе и других жидкостях организма ("гуморос" – жидкость);
Антимикробный иммунитет может быть стерильным и нестерильным.
Стерильный иммунитет сохраняется при отсутствии микробов в организме.
Нестерильный иммунитет сохраняется только при наличии микробов в организме.
Русский ученый А.М. Безредка выделил еще так называемый местный иммунитет- невосприимчивость в месте проникновения микробов в организм (невосприимчивость слизистых оболочек кишечника, дыхательных путей, кожи). Этот иммунитет связан с секреторными антителами (иммуноглобулины А) и фагоцитозом.
17. Специфический и неспецифический иммунитет. Роль лимфоцитов в образовании антител. Механизм иммунного ответа.
См. 16
18. Антитела и антигены. Механизмы элиминации антигенов.
Антитела — это сложные белки (глюкопротеиды), которые образуются в организме теплокровных животных в ответ на поступление антигена и способные специфически взаимодействовать с этим антигеном. Являются главными эффекторными молекулами гуморального иммунитета у животных.
Антитела содержатся в гамма-глобулиновой фракции сыворотки крови и в лимфе (циркулирующие антитела), в молозиве и секретах (секретирующие антитела), на поверхности клеток, например, эпителия слизистых оболочек (связанные с мембраной антитела). В настоящее время антитела принято называть иммуноглобулинами.
В сумме они составляют около 1 / 5 массы всех сывороточных белков. Схематично молекула иммуноглобулинов состоит из четырех полипептидных цепей, соединенных между собой дисульфидными мостиками. По молекулярной массе различают две одинаковые легкие цепи и две одинаковые тяжелые цепи. В молекуле имеются два антигенсвязывающих участка, в построение которых легкие и тяжелые цепи вносят
равный вклад. Антигенные свойства иммуноглобулина определяет ≪хвостовая≫ область, которая образуется только Н-цепями.

Антитела могут способствовать уничтожению чужеродных тел (например, микробов) с помощью трех разных механизмов: усиления фагоцитоза (путем связывания с рецепторами макрофагов и нейтрофилов), активации системы комплемента (белкового комплекса сыворотки, участвующего в реакции антиген — антитело и вызывающего ллизис клеток), стимуляции функции К-клеток (лимфоцитов без Т- или В-маркеров, обладающих цитотоксическим действием). Кроме того, антитела могут присоединяться к вирусам или бактериальным токсинам и предотвращать их связывание с рецепторами на клетках-мишенях. В крови сельскохозяйственных животных (крупного рогатого скота,
свиней, овец, коз и лошадей) обнаружено 3 класса иммуноглобулинов: IgG, IgA, IgM. У новорожденных животных антитела в крови отсутствуют, впервые они получают их
с молозивом матери. Собственный синтез антител начинается у телят с двухнедельного
возраста, но происходит очень медленно, что связано с функциональной незрелостью лимфоидной ткани.
Антиген - это любая молекула, которая специфично связывается с антителом. По отношению к организму антигены могут быть как внешнего, так и внутреннего происхождения. Хотя все антигены могут связываться с антителами, не все они могут вызвать массовую продукцию этих антител организмом, то есть иммунный ответ. Антиген, способный вызывать иммунный ответ организма, называют иммуногеном Антигены, как правило, являются белками или полисахаридами и представляют собой части бактериальных клеток, вирусов и других микроорганизмов. Липиды и нуклеиновые кислоты, как правило, проявляют иммуногенные свойства только в комплексе с белками.
Комплементарные, т. е. взаимно соответствующие друг другу антигены и антитела, образуют иммунный комплекс антиген — антитело. Прочность таких структур определяется высокой избирательностью и большой площадью взаимодействия на
уровне атомных группировок или зарядов
|
|
|


