 |
Длительность стационарного лечения
|
|
|
|
ИНФАРКТ МИОКАРДА
Учебное пособие
Иркутск
Утверждено ФМС Иркутского медицинского университета 11.12..2006 г.
протокол № 3
Рецензенты:
С.Г.Куклин – д.м.н., профессор кафедры терапии и кардиологии Иркутского ГИУВа
Редактор серии:
зав. кафедрой факультетской терапии, проф., д.м.н. Козлова Н.М
Белялов Ф.И. Инфаркт миокарда. Иркутск; 2013. 28 c.
Учебное пособие посвящено современной диагностике и лечению инфаркта миокарда – одного из самых опасных заболеваний человека, и предназначено для интернов, клинических ординаторов и практических врачей. В настоящем издании учтены последние достижения медицинской науки и практики.
Издательство: Иркутск ООО “Форвард”
© Ф.И.Белялов, 2013 Иркутский государственный медицинский университет
СОДЕРЖАНИЕ
ЭПИДЕМИОЛОГИЯ.. 4
АНАТОМИЯ И ФИЗИОЛОГИЯ.. 4
ПАТОГЕНЕЗ. 5
ДИАГНОСТИКА.. 6
Клиника. 6
Сердечные биомаркеры.. 7
ЭКГ. 8
Эхокардиография. 12
Критерии диагноза. 13
Формулировка диагноза. 14
ЛЕЧЕНИЕ. 14
Реперфузия. 17
Гепарин. 20
Ингибиторы Ха-фактора. 21
Другие методы лечения. 21
Длительность стационарного лечения. 22
Лечение осложнений. 22
Реанимация при остановке сердца. 24
ЛИТЕРАТУРА.. 27
СОКРАЩЕНИЯ
| АД | – артериальное давление |
| ВНОК | – Всероссийское научное общество кардиологов |
| ИАПФ | – ингибиторы ангиотензин-превращающего фермента |
| ИБС | – ишемическая болезнь сердца |
| ИМ | – инфаркт миокарда |
| ИМБП ST | – инфаркт миокарда без стойкого подъема сегмента ST на ЭКГ |
| ИМП ST | – инфаркт миокарда с подъемом сегмента ST на ЭКГ |
| ХС ЛПНП | – холестерин липопротеинов низкой плотности |
| ЧСС | – частота сердечных сокращений |
| ЭКГ | – электрокардиограмма |
| ACC | – American College of Cardiology |
| ADA | – American Diabetic Association |
| AHA | – American Heart Association |
| ESC | – European Society of Cardiology |
| NHLBI | – National Heart, Lung, and Blood Institute |
| NCEP | – National Cholesterol Education Program |
ЭПИДЕМИОЛОГИЯ
|
|
|
Ишемическая болезнь сердца (ИБС) является ведущей причиной смерти населения. От этого заболевания в 2005 году погибло 7.2 млн человек на Земле. Чаще всего летальные исходы связаны с инфарктом миокарда (ИМ) – некрозом сердечных миоцитов, вызванным длительной ишемией миокарда (ESC/ACCF/AHA/WHF, 2007).
По статистическим данным в Иркутске в 2007 году от ИМ умерло 226 человек. Основная часть пациентов умирает на догоспитальном этапе – не случайно, число умерших от ИБС было почти в 8 раз больше (1765 человек). Больничная летальность от ИМ по данным пяти крупных стационаров, оказывающих неотложную помощь, составила 14.2%, а от ИМ с зубцом Q – 17.9%.
АНАТОМИЯ И ФИЗИОЛОГИЯ
Миокард получает кровь из двух коронарных артерий – правой и левой, устья которых располагаются в корне аорты у створок аортального клапана. Ветви левой коронарных артерии снабжают кровью левый желудочек, межжелудочковую перегородку, левое и частично правое предсердие, ветви правой – стенки правой половины сердца. Левая коронарная артерия разделяется обычно на две или три артерии, из которых наибольшее значение для патологии имеют передняя нисходящая и огибающая артерии. Крупные стволы артерии, проходят по поверхности сердца и отдают ветви, уходящие вглубь под прямым углом с ветвлениями достигают восьми порядков.
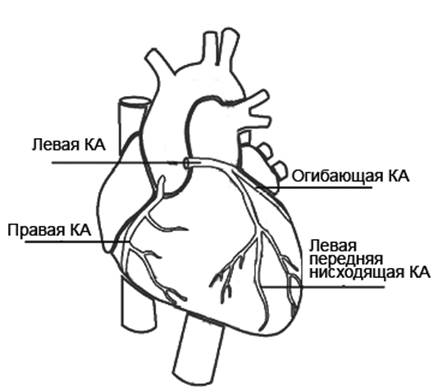
Рисунок 1. Расположение коронарных артерий сердца.
Интенсивность коронарного кровотока в норме зависит от потребности сердца в кислороде, которая составляет 6–8 мл кислорода в 1 мин на 100 г массы сердца в покое. Повышение энергетического обмена при усилении работы сердца обеспечивается за счет увеличения скорости коронарного кровотока, прирост которого происходит за счет расширения коронарных сосудов, открытия капилляров, а также вследствие подъема артериального давления (АД). Эти факторы позволяют увеличивать кровоток в 5–7 раз при возрастании работы сердца.
|
|
|
ПАТОГЕНЕЗ
Медленно развивающийся атеросклеротический стеноз эпикардиальных коронарных артерий может прогрессировать до полной окклюзии, которая обычно не вызывает ИМ, поскольку развиваются коллатеральные сосуды. Основная опасность связана с разрывом фиброзной капсулы атеросклеротической бляшки или эрозией ее поверхности, что вызывает активацию тромбоцитов и образование тромбина с окклюзией артерии. Бляшки, склонные к разрывам, чаще всего небольшие, богаты липидами и клетками воспаления, и расположены в области разветвлений сосудов. Если коллатеральное кровоснабжение недостаточное, то через 15 мин волна некроза миокарда начинает распространяться от эндокарда к эпикарду.
Кроме описанного типа, выделяют несколько разновидностей ИМ в зависимости от механизма развития некроза сердечной мышцы (таблица 1).
Таблица 1. Классификация типов инфаркта миокарда (ESC/ACCF/AHA/WHF, 2007).
| Тип | Характеристика |
| Спонтанный ИМ, обусловленный ишемией миокарда вследствие эрозии и/или надрыва атеросклеротической бляшки | |
| ИМ, обусловленный ишемией миокарда вследствие увеличения потребности миокарда в 02 или ухудшения кровоснабжения, например, в результате спазма коронарных артерий, их эмболии, анемии, аритмии, ¯ или АД. | |
| Внезапная неожиданная сердечная смерть, часто с симптомами возможной ишемии миокарда, сопровождающихся предположительно новыми подъемами ST, или новой блокадой ЛНПГ, или признаками свежего тромбоза в коронарной артерии при ангиографии и/или аутопсии, когда смерть наступает до сдачи анализа крови или в период до появления сердечных биомаркеров в крови. | |
| 4а | ИМ связанный с чрескожным коронарным вмешательством. |
| 4b | ИМ связанный с тромбозом стента по данным ангиографии или аутопсии. |
| ИМ связанный с коронарном шунтированием. |
При полной окклюзии коронарной артерии обычно формируется ИМ с зубцом Q, а при неполной окклюзии – нестабильная стенокардия или ИМ без зубца Q (рисунок 2).
|
|
|

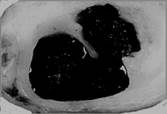
Рисунок 2. Окклюзия коронарной артерии: слева – неполная, справа – полная.
В процессе развития заболевания выделяют несколько периодов ИМ, основанных на морфологических данных:
♦ развивающийся ИМ - до 6 ч
♦ острый ИМ - от 6 ч –до 7 сут
♦ заживающий ИМ - от 7 до 28 сут
♦ заживший ИМ - с 29 сут
Заметим, что данная классификация не соответствует динамике ЭКГ и тактике ведения.
ДИАГНОСТИКА
Диагностика ИМ основывается на оценке клинических проявлений, электрокардиограммы (ЭКГ) и маркеров некроза миоцитов. В тех случаях когда есть клинические симптомы, позволяющие подозревать ИМ, но нет надежного подтверждения диагноза используется термин острый коронарный синдром. При последующем наблюдении и диагностике устанавливается более определенный диагноз: ИМ или нестабильная стенокардия.
Клиника
Вопреки распространенному мнению, ИМ проявляется чаще дискомфортом, а не интенсивными болями в грудной клетке. Для типичной клиники ИМ характерен длительный дискомфорт в области грудины более 30 мин, отсутствие связи с положением тела, кашлем и дыханием, а также неэффективность нитроглицерина.
В одной трети случаев регистрируется атипичная или даже бессимптомная клиника ИМ. Особенно часто нетипичные проявления ИМ встречаются у пожилых, больных сахарным диабетом или другими тяжелыми заболеваниями. Атипичная клиника может проявляется по–разному:
· дискомфорт в шее, челюсти, руках, межлопаточной области, эпигастрии
· одышка
· общая слабость
· обморок
· острое нарушение мозгового кровообращения
· тошнота
Для точной постановки диагноза существенное значение может иметь априорная вероятность заболевания. Если вероятность заболевания высокая, то даже недостаточно характерные признаки следует серьезно рассматривать как проявления ИМ. При низкой вероятности заболевания нередки ложно–положительные результаты. Факторами, повышающими вероятность ИБС у пациента, являются следующие: возраст >50 лет, артериальная гипертензия, гиперхолестеринемия, курение, сахарный диабет, ожирение, семейный анамнез ранней ИБС.
|
|
|
Сердечные биомаркеры
При повреждении сердечных миоцитов в плазму крови выходят внутриклеточные вещества, некоторые из них используются как маркеры некроза или повреждения миокарда. В настоящее время для диагностики ИМ применяют оценку таких сердечных биомаркеров как миоглобин, креатинкиназа МВ, тропонины Т и I (таблица 2).
Особенно полезны сердечные биомаркеры для диагностики ИМ при отсутствии типичных изменений на ЭКГ. Основная проблема заключается в достаточно позднем обнаружении индикаторов в плазме. Например, тропонин Т выявляется при ИМ в первые 4 ч только в 50% случаев. Оптимальным считают время взятия анализа на тропонин 6–9 ч (NHLBI, 2007). Точность полуколичественных тестов (например, «Троп Т»), ниже чем количественных, особенно в первые часы.
Раньше всего (в среднем через 2 ч) при ИМ повышается в плазме содержание миоглобина, что важно при недавно возникшем дискомфорте в груди при отсутствии повреждения скелетных мышц. При позднем поступлении пациента для диагностики ИМ ценно свойство тропонинов сохраняться в крови до 1–2 недель. Вместе с тем, ранние повторные ИМ лучше выявлять с помощью креатинкиназы МВ, повышение активности которой регистрируется в плазме до 48–72 ч.
Наиболее чувствительным индикатором некроза миокарда являются тропонины. Например, у пациентов с острым коронарным синдромом без подъема сегмента ST при нормальном уровне креатинкиназы МВ в трети случаев определяется повышение тропонина Т, позволяя диагностировать ИМ.
Таблица 2. Время повышения уровня маркеров некроза при ИМ (ACC/AHA, 2004; NACB, 2007).
| Маркер | начало (ч) | пик (ч) | длительность (сут) |
| Креатинкиназа МВ | 3-12 | 2–3 | |
| Тропонин I | 3-12 | 4–7 | |
| Тропонин T | 3-12 | 12–48 | 10–14 |
| Миоглобин | 1-4 | 6–7 |
Поскольку повреждение миокарда любой природы (воспаление, травма, острая перегрузка) и почечная недостаточность могут вызвать повышение уровня сердечных биомаркеров в крови, диагностика ИМ основывается на характерной динамике исследуемых веществ.
ЭКГ
Основные критерии
Как правило, при ИМ появляются изменения на ЭКГ. Если ЭКГ недиагностическая и сохраняется подозрение на ИМ рекомендуется повторная регистрация ЭКГ через каждые 5–10 мин или мониторинг 12 отведений ЭКГ.
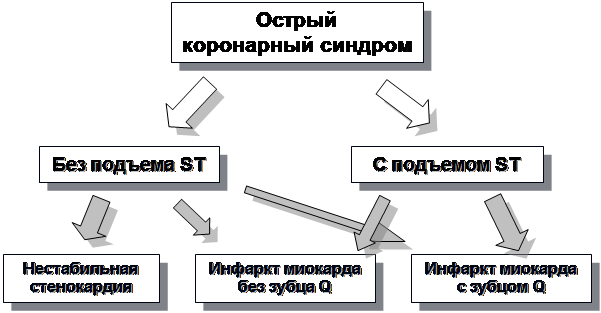
На основании феноменологии ЭКГ выделяют острый коронарный синдром без подъема сегмента ST и с подъемом сегмента ST, ИМ с зубцом Q и без зубца Q (рисунок 3). Такая классификация коррелирует со временем от начала ИМ, степенью поражения миокарда, течением и прогнозом заболевания.
|
|
|
Рисунок 3. Классификация и динамика форм острой ишемии миокарда (ACC/AHA, 2004).
В первые часы ИМ на ЭКГ обычно регистрируются признаки острой ишемии миокарда: смещение сегмента ST или инверсия зубца Т. Поскольку не всегда в этих случаях развивается ИМ, то в начале обычно используют термин острый коронарный синдром.
Критерием подъема сегмента ST считается повышение в точке J (начало сегмента ST) ³2 мм у мужчин и ³1.5 мм у женщин в отведениях V2-3 и/или ³1 мм в других отведениях (ESC/ACCF/AHA/WHF).
В последующем формируется патологический комплекс QS или зубец Q (рисунки 4, 5, 6, 7). Патологическим считается комплекс QS или любой зубец Q ³0.02 сек в отведениях V2-3 или ³0.03 сек и глубиной ³1 мм в двух смежных отведениях (I, aVL, V6; V4-V6; II, III, aVF). В случае ИМ в правом желудочке выявляют зубец R продолжительностью ³0.04 сек в отведениях V1-2 и соотношением R/S > 1 в сочетании с конкордантным позитивным зубцом T при отсутствии нарушений проводимости. Такой ИМ с зубцом Q характеризуется более тяжелым течением и высоким риском осложнений (таблица 3).

Рисунок 4. Типичная динамика ЭКГ при ИМ с зубцом Q.
Заметим, что наличие зубца Q ассоциируется в большей степени с площадью поражения, чем числом участков трансмурального некроза миокарда (Moon J.C. et al, 2004). Периодизация динамики ЭКГ при ИМ с зубцом Q (острейший, острый и подострый период) в настоящее время утратила свое значение, поскольку не соответствует современной тактике ведения ИМ.
Таблица 3. Характеристика ИМ с зубцом Q и без зубца Q.
| Признак | ИМ с зубцом Q | ИМ без зубца Q |
| Окклюзия коронарной артерии | Полная | Неполная (70%) |
| Площадь некроза | Большая | Малая |
| Глубина поражения | Трансмуральный (70%) | Субэндокардиальный (70%) |
| Осложнения (шок, отек легкого) | Нередко | Очень редко |
| ЭКГ | ST, Q | ¯ST, T- |
| Реинфаркты, стенокардия | Редко | Часто (16% в 1 год) |
| Противотромботическая терапия | Тромболитики | Гепарин |
При острых коронарных синдромах без подъема сегмента ST на ЭКГ регистрируют горизонтальные или нисходящие депрессии сегмента ST ³0.5 мм или инверсию зубца Т ³1 мм в 2 смежных отведениях с доминирующим зубцом R или соотношением R/S >1 (ESC/ACCF/AHA/WHF, 2007).
Очень важным для точной интерпретации ЭКГ является сравнительная оценка ЭКГ с пленками, предшествующими данному острому коронарному эпизоду.
Чем более выражены изменения на ЭКГ (глубже депрессия ST и зубец Т, больше отведений), тем выше вероятность острого коронарного синдрома и хуже прогноз.
Первоначальная депрессия сегмента ST или инверсия зубца Т при ИМБП ST обычно сохраняется несколько дней–недель, постепенно нивелируясь (рисунок 7). Важно отметить, что не существует надежных электрокардиографических признаков (включая «коронарный» зубец Т и медленную динамику сегмента ST и зубца Т), позволяющих установить диагноз ИМ.

Рисунок 5. Электрокардиографическая динамика ИМ с зубцом Q.
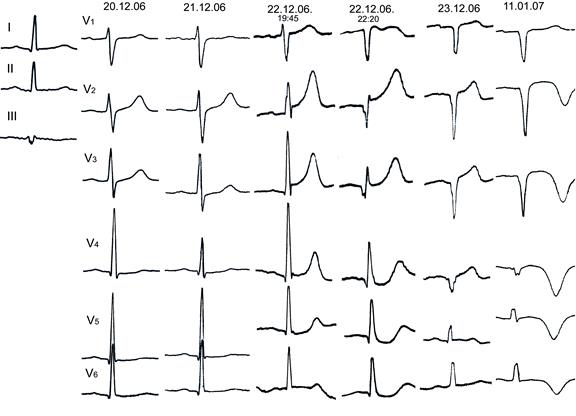
Рисунок 6. ЭКГ в динамике у мужчины 40 лет с ангинозными болями около 1 часа ночью 20.12.06, в последующие дни болей не было.

|
 |


Рисунок 8. Электрокардиографическая динамика ИМ без зубца Q. 21.08 слабый дискомфорт за грудиной в течение 10 часов. Выраженные ангинозные боли, купированные морфином, 5.09.
Локализация
Локализация ИМ определяется по характерным изменениям в определенных отведениях ЭКГ (рисунок 9). Согласно современным рекомендациям целесообразно вместо «задняя стенка» использовать термин «нижнее–базальная стенка» левого желудочка.
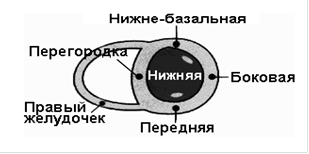

Рисунок 9. ЭКГ диагностика локализации ИМ – слева стенки желудочков, справа – отведения.
Особенности клинической картины и лечения в зависимости от локализации ИМ по данным ЭКГ представлены в таблице 4.
Таблица 4. Клиническая характеристика ИМ разной локализации.
| Локализация | Диагностика | Лечение |
| Передний | Высокая летальность и риск осложнений. | Наибольший эффект тромболизиса. |
| Нижний | Абдоминальные боли. Нередко синусовая брадикардия и АВ блокада. Необходима регистрация V4R. Хороший прогноз. | Умеренный эффект тромболизиса. |
| Задний | Двухмерная эхокардиография обладает высокой отрицательной предсказательной ценностью. Регистрация V7-8. Хороший прогноз. | Умеренный эффект тромболизиса. |
| Правый желудочек | До 30% при нижнем ИМ и до 10% при переднем ИМ. Регистрация V4R. Возможна гиповолемия с гипотензией или шоком. | Опасны нитраты. При гипотензии – инфузия. |
Большие трудности в диагностике ИМ появляются при наличии блокады ножки пучка Гиса, особенно левой. Впервые возникшая блокада левой ножки пучка Гиса рассматривается как эквивалент ИМП ST и является основанием для проведения тромболизиса при наличии других признаков ИМ.
Эхокардиография
Эхокардиография используется в основном для дифференциальной диагностики (расслоение аорты, массивная тромбоэмболия легочной артерии) и выявления осложнений (разрыв миокарда, митральная регургитация, выпот в перикард, внутрисердечный тромб).
Собственно для определения ИМ метод имеет ограниченную ценность, поскольку нарушение локальной сократимости миокарда встречается как при остром некрозе, так и при ишемии миокарда или перенесенном ИМ. Кроме того, этот феномен возможен при миокардите и дилатационной кардиомиопатии. С другой стороны, отсутствие локального нарушения сократимости исключает только большой ИМ.
Критерии диагноза
Современные международные критерии диагноза ИМ представлены в таблицах 5 и 6. Данные критерии при отсутствии типичных изменений на ЭКГ (ST, патологический зубец Q) ориентируют врача на ведущую роль в диагностике ИМ маркеров некроза миокарда. Вместе с тем, при наличии ST целесообразно не ждать результатов биохимического анализа, а быстрее проводить реперфузию (медикаментозную или инвазивную).
Таблица 5. Критерии острого инфаркта миокарда (ESC/ACCF/AHA/WHF, 2007).
| · Подъем и/или снижение уровня сердечных биомаркеров (предпочтительнее тропонин) если хотя бы в одном анализе превышена норма *, и имеется ≥1 признака: o клинические симптомы ишемии миокарда; o ЭКГ признаки ишемии миокарда (новые изменения ST-T или БЛНПГ); o формирование патологических зубцов Q на ЭКГ; o визуальные признаки новой потери жизнеспособного миокарда или нарушений локальной сократимости. · Внезапная неожиданная смерть, часто с симптомами ишемии миокарда, и сопровождающаяся предположительно новыми ST или БЛНПГ и/или признаками свежего тромба при коронарной ангиографии и/или аутопсии, если смерть наступила до того взятия пробы крови или до появления сердечных биомаркеров в крови. · В случае чрескожного коронарного вмешательства, если уровень сердечных биомаркеров исходно был нормальным, а после вмешательства превышает норму* ≥3 раза. Как частный случай - ИМ обусловленный тромбозом стента. · В случае коронарного шунтирования если уровень сердечных биомаркеров исходно был нормальным, а после вмешательства превышает норму* ≥5 раз + ангиографические признаки новой окклюзии коронарной артерии или шунта, или ЭКГ признаки ИМ (новый патологический Q или новая БЛПНГ), или визуализационные признаки новой потери жизнеспособного миокарда или новые нарушения локальной сократимости. · Признаки острого инфаркта миокарда на аутопсии. |
Примечания: * – 99 перцентиль показателя в контрольной группе здоровых лиц в данной лаборатории.
Таблица 6. Критерии перенесенного инфаркта миокарда (ESC/ACCF/AHA/WHF, 2007).
| · Развитие новых патологических зубцов Q c симптомами или без них. · Визуализационные признаки утраты жизнеспособного миокарда, т.е. истонченного и не сокращающегося, при отсутствии неишемической причины. · Патоморфологические признаки зажившего или заживающего инфаркта миокарда. |
Формулировка диагноза
Диагноз при развитии ИМ часто меняется в зависимости от изменений ЭКГ и развития осложнений. Например, врач скорой помощи устанавливает диагноз «острый коронарный синдром», в палате интенсивной терапии после регистрации ЭКГ и определения маркеров некроза миокарда диагноз уточняют – «инфаркт миокарда с подъемом сегмента ST», а при выписке из больницы – «инфаркт миокарда с зубцом Q».
Для ИМ с зубцом Q используется шифр Международной классификации болезней I21.0-3, для ИМ без зубца Q – шифр I21.4, если же имеет место повторный инфаркт миокарда, то применяют шифр I22.
Примеры формулировки диагноза:
| · ИБС: Острый коронарный синдром без подъема сегмента ST (12:40, 12.04.04). | I21 |
| · ИБС: Инфаркт миокарда с подъемом сегмента ST нижней стенки левого и правого желудочков (12.04.04). | I21 |
| · ИБС: Инфаркт миокарда с зубцом Q переднее–септальной области левого желудочка, тип 1 (12.04.04). Осложнение: Острая сердечная недостаточность, III класс по Killip. Пароксизмальная устойчивая желудочковая тахикардия. | I21.0 |
| · ИБС: Инфаркт миокарда без зубца Q боковой стенки левого желудочка (12.04.04). | I21.4 |
| · ИБС: Повторный инфаркт миокарда (2:34 22.03.06). ПИКС (1998, 2001). Осложнение: Тромб левого желудочка. Хроническая сердечная недостаточность, 3 ФК, 2б стадия. | I22.9 |
В тех случаях, когда имеет место острая сердечная недостаточность, вероятная ИБС без клиники ангинозных болей и признаков ИМ можно использовать диагноз ИБС: Острая ишемия миокарда (шифр I24.9), близкий с устаревшему термину «острая коронарная недостаточность».
ЛЕЧЕНИЕ
Общая схема лечения неосложненного ИМ (или острого коронарного синдрома здесь и далее по тексту) в соответствии с течением заболевания представлена на рисунках 10 и 11.
Первоочередные мероприятия при появлении ишемического дискомфорта в груди включают сублингвальный прием одной дозы нитроглицерина (таблетка или спрей), а при отсутствии эффекта от одной дозы – вызов бригады скорой помощи (ACC/AHA, 2004). При отсутствии артериальной гипотензии можно повторить прием нитроглицерина до 3 раз с интервалом 5 мин. Кроме того, необходимо разжевать аспирин (162–250 мг, лучше без кишечнорастворимой оболочки). В настоящее время рекомендуют наряду с аспирином как можно быстрее назначить клопидогрел в дозе 300 мг (AHA, ESC, ВНОК, 2007).

Рисунок 10. Общая схема лечения при остром коронарном синдроме без подъема ST (ESC, 2003; ACC/AHA, 2007). ЧКВ – чрескожное коронарное вмешательство, ОСН – острая сердечная недостаточность, ИМП ST – инфаркт миокарда с подъемом ST, ОКСБП ST – острый коронарный синдром без подъема ST, ИАПФ – ингибиторы ангиотензинпревращающего фермента.

 Рисунок 11. Общая схема лечения при остром коронарном синдроме без подъема ST (ESC, 2007). ОСН – острая сердечная недостаточность, ИМП ST – инфаркт миокарда с подъемом ST, ОКСБП ST – острый коронарный синдром без подъема ST, ИАПФ – ингибиторы ангиотензинпревращающего фермента.
Рисунок 11. Общая схема лечения при остром коронарном синдроме без подъема ST (ESC, 2007). ОСН – острая сердечная недостаточность, ИМП ST – инфаркт миокарда с подъемом ST, ОКСБП ST – острый коронарный синдром без подъема ST, ИАПФ – ингибиторы ангиотензинпревращающего фермента.
Для выживания пациентов критически важным является быстрая госпитализация. Месячная смертность от нелеченного ИМ составляет 30–50%, при этом половина случаев приходится на первые 2 часа (Armstrong B. et al, 1972; Tunsdull-Pedoe H. et al, 1999). В Иркутске в 2006 году 47% госпитальных смертей от ИМ приходилось на 1 сутки заболевания. В то же время госпитальная летальность при своевременном проведении тромболизиса и инвазивного коронарного лечения составляет 6–8%.
Бригада скорой помощи обезболивает морфином (2–4 мг внутривенно, при необходимости от 2 до 8 мг повторно через 5–15 мин) и доставляет в госпиталь, имеющий палату интенсивного наблюдения. Заметим, то нецелесообразно тратить время на ожидание специализированной бригады скорой помощи (ВНОК, 2006).
Реперфузия
Для эффективного лечения ИМП ST важнейшее значение имеет быстрейшее восстановление кровотока по окклюзированной коронарной артерии – реперфузия. С этой целью используют фармакологический лизис тромба (тромболизис, фибринолиз) или внутрикоронарное вмешательство (балонная ангиопластика).
Показания для реперфузии
· <12 ч от начала дискомфорта
· ЭКГ:
а) ST ≥1 мм по меньшей мере в 2 смежных грудных отведениях (V1–6) или 2 отведениях от конечностей (I-III);
б) новая или предположительно новая блокада левой ножки пучка Гиса.
Фармакологическая реперфузия
Тромболитическая терапия предпочтительнее инвазивного лечения в следующих случаях (ACC/AHA, 2004):
· задержка инвазивной реперфузии >90 мин от контакта с медиком
· задержка инвазивного лечения >60 мин по сравнению с тромболизисом
· недостаточный опыт инвазивных вмешательств
· <3 часов от начала симптомов
· отсутствие противопоказаний к тромболитикам (таблица 7)
· анафилаксия на рентгенконтрастные препараты
Возможно применение тромболизиса в период 12-24 ч в случае продолжающихся ишемических симптомов при ST, соответствующего вышеописанным критериям.
Догоспитальный тромболизис по данным мета–анализа повышает выживаемость на 17% по сравнению с госпитальными тромболизисом. В этом случае предпочтительнее болюсное введение ретеплазы или тенектеплазы.
Для госпитального внутривенного тромболизиса чаще используют стрептокиназу и тканевой активатор плазминогена (таблица 8). В большинстве крупных исследованиях летальность достоверно не отличалась при использовании разных тромболитиков (GISSI-2, ISIS-3, INJECT, ISG).
Стрептокиназа значительно дешевле других тромболитиков, но не может быть эффективно использована для лечения реинфарктов в связи с выработкой нейтрализующих антител, которые сохраняются в достаточной концентрации у большинства пациентов в течение более 10 лет. По–видимому, возможно повторное применение стрептокиназы в первые 3 дня после первого введения.
Таблица 7. Противопоказания для тромболизиса (ACC/AHA, 2004)
| АБСОЛЮТНЫЕ |
| · Геморрагический инсульт любой давности · Ишемический инсульт в течение 3 мес, исключая первые 3 ч · Патология сосудов (например, артериовенозная мальформация) · Внутричерепное новообразование · Активное внутреннее кровотечение (не menses) или кровоточащий диатез · Подозрение на расслоение аорты · Значительная закрытая травма головы или травма лица в течение 3 мес |
| ОТНОСИТЕЛЬНЫЕ |
| · Анамнез хронической, тяжелой, плохо контролируемой гипертензии · Неконтролируемая артериальная гипертензия >180/110 мм рт. ст. · Ишемический инсульт после 3 мес, деменция или внутричерепная патология не отмеченная в противопоказаниях · Прием антикоагулянтов: чем выше МНО, тем выше риск кровотечения · Травматичная или длительная (>10 мин) реанимация, или большая хирургия в предшествующие 3 нед · Пункция некомпрессируемых сосудов · Недавнее (до 2-4 нед) внутреннее кровотечение · Беременность · Активная пептическая язва · Для стрептокиназы: предшествующее (>5 дней назад) использование стрептокиназы или аллергическая реакция на эти препараты |
Примечание: МНО – международное нормализованное отношение.
В случае развития гипотензии при введении стрептокиназы временно прекращают инфузию, придают пациенту горизонтальное положение или поднимают ноги. Редко требуется введение атропина или инфузия. Профилактическое назначение кортикостероидов вместе со стрептокиназой не рекомендуется.
Таблица 8. Характеристики препаратов для тромболизиса.
| Признак | Дозы | Особенности |
| Стрептокиназа | 1.5 млн за 30-60 мин | Не вводятся повторно Возможна гипотензия Гепарин при высоком риске тромбоэмболий |
| Проурокиназа | 2 млн МЕ болюс + 6 млн инфузия за 60 мин | Гепарин при высоком риске тромбоэмболий |
| Альтеплаза | 100 мг за 90 мин | Всем 48 ч инфузия нефракционированного гепарина или п/к низкомолекулярный гепарин |
| Тенектеплаза | болюс 30-50 мг |
После тканевого активатора плазминогена показана внутривенная инфузия гепарина (вначале 60 ед/кг [£4000 ед], далее инфузия 12 ед/кг*ч [£1000 ед/ч]) длительностью ³48 ч, которая дополнительно снижает летальность. Возможной альтернативой инфузии нефракционированного гепарина является введение низкомолекулярного гепарина подкожно у пациентов до 75 лет без нарушения функции почек (креатинин в плазме <220 мкмоль/л [м], <176 мкмоль/л [ж]) (EXTRACT, Eikelboom J.W. et al, 2006).
Геморрагический инсульт – основная опасность фибринолитической терапии – встречается в 4 случаях из 1000, несколько чаще после тканевого активатора плазминогена.
Критериями эффективного внутривенного тромболизиса считаются облегчение симптомов, улучшение гемодинамики, а также ¯ST >50% от исходного уровня к 60–90 мин после начала лечения. В этот период может регистрироваться желудочковый ускоренный ритм, не требующий лечения.
При неэффективности тромболизиса повторный тромболизис не дает дополнительного эффекта, а коронарная ангиопластика с одной стороны снижает риск сердечной недостаточности (–27%) и реинфаркта (–42%), а с другой повышает почти в 5 раз частоту инсульта и малых кровотечений при недостоверном снижении общей смертности (Wijeysundera H.C. et al, 2007).
Инвазивная реперфузия
Инвазивное восстановление кровотока в сердце с помощью чрескожного коронарного вмешательства (балонной ангиопластики) показано пациентам с ИМП ST при следующих условиях (ACC/AHA, 2004):
· достаточный опыт и квалификация (опыт врача ≥75 вмешательств в год, лаборатории ≥200 вмешательств в год, из них ≥36 первично при ИМ)
· организация инвазивного лечения до 90 мин после контакта с медиком
· начало лечения <60 мин по сравнению с тромболизисом
· высокий риск смерти (шок, влажные хрипы >50% поверхности легких)
· противопоказания к тромболизису
· переносимость рентгенконтрастных препаратов
· >3 и <12 часов от начала симптомов
· сомнения в диагнозе ИМП ST
При соблюдении вышеописанных условий при инвазивном вмешательстве по сравнению с госпитальным тромболизисом лучше восстанавливается проходимость и функция левого желудочка, ниже риск реокклюзии и более благоприятный исход. Особенно эффективно инвазивная реперфузия по сравнению с тромболизисом снижает смертность у пациентов с высоким риском неблагоприятного исхода и при передней локализации ИМ. В настоящее время в 60% реперфузия проводится инвазивным методом в странах Европы (Mandelzweig L. et al, 2006). Наличие зубца Q повышает летальность, в связи с чем также возможно эффективнее инвазивная реперфузия (HERO-2).
Вместе с тем, при реперфузии в первые 2–3 часа результаты тромболизиса были по меньшей мере не хуже, чем чрескожного коронарного вмешательства (CAPTIM, PRAGUE-2).
Стентирование не влияет существенно на летальность и риск реинфарктов, но снижает частоту последующих реваскуляризаций со стентированием (Cochrane review, 2005). Активные стенты, покрытые антипролиферативными цитостатическими препаратами (сиролимус, паклитаксел) не дают дополнительных преимуществ.
Cовременные исследования не доказали необходимость восстановления коронарного кровотока по окклюзированной инфаркт–связанной артерии в последующие 3–28 сут после ИМ (Hochman J.S. et al, 2006).
При первичном чрескожном коронарном вмешательстве эффективны ингибиторы IIb/IIIa–рецепторов тромбоцитов (абсикцимаб).
У пациентов с ИМ (острым коронарным синдромом) без подъема ST основанием для инвазивного лечения считают высокий риск осложнений, критериями которого являются:
· повторные эпизоды ишемии миокарда
· тропонинов или креатинкиназы МВ в крови
· гемодинамическая нестабильность
· тяжелые аритмии
· сахарный диабет
Ранее (без попытки стабилизации состояния) инвазивное лечение острого коронарного синдрома без подъема сегмента ST может улучшить симптоматику заболевания в случаях применения антагонистов IIb/IIIa рецепторов тромбоцитов и стентирования (FRISC II, TACTICS-3, RITA).
Гепарин
При ИМП ST гепарин применяют после тромболизиса препаратами альтеплаза и тенектеплаза, а при наличии факторов высокого риска тромбоэмболий (распространенный или передний ИМ, фибрилляция предсердий, предшествующие эмболии, тромб левого желудочка, шок) – после любого тромболитика. Низкомолекулярные гепарины (эноксапарин), по–видимому, эффективнее нефракционированного препарата при ИМП ST – снижение смертности и повторного ИМ перекрывает повышение риска кровотечений по данным мета–анализа исследований (Murphy S.A. et al, 2007).
У пациентов с ОКСБП ST гепарин (инфузия нефракционированного или подкожно низкомолекулярный) применяется вместе с аспирином и клопидогрелем. Гепарин не снижает летальность, частоту рецидива стенокардии и реваскуляризации, но уменьшает риск ИМ (Cochrane Reviews, 2008).
Нефракционированный гепарин назначают обычно 48 ч в дозе 60 ед/кг [£4000–5000 ед] внутривенно с последующей инфузией 12-15 ед/кг*ч [£1000 ед/ч], добиваясь повышения активированного частичного тромбопластинового времени в 1.5–2.5 раза. Нефракционированный гепарин применяют если планируется инвазивное лечение.
Низкомолекулярные гепарины удобнее для введения и не требуют контроля коагулограммы, однако у пожилых чаще вызывают кровотечения, чем обычный гепарин (SYNERGY, 2008). Эноксапарин вводят подкожно 1 мг/кг каждые 12 ч с возможным предварительным болюсом внутривенно 30 мг. Рекомендуется введение низкомолекулярного гепарина в течение 2-8 суток.
Ингибиторы Ха-фактора
Фондапаринукс в дозе 2.5 мг подкожно при ИМБП ST не менее эффективно снижает летальности и частоту ИМ и почти в 2 раза реже вызывает большие кровотечения, чем эноксапарин (OASIS-5).
Другие методы лечения
Дезагреганты. У пациентов с ИМБП ST вместе с аспирином назначают клопидогрел (300 мг в первый день и 75 мг в последующие) по крайней мере до 1 мес и далее желательно до года (ACC/AHA, 2007). По данным исследования COMMIT целесообразно назначать клопидогрел в дополнение к аспирину в течение хотя бы 2 недель при ИМП ST.
Бета–блокаторы. Бета–блокаторы (метопролол, пропранолол) снижают летальность при ИМ и особенно показаны при стенокардии, тахиаритмиях или гипертензии. Применение препаратов в первые сутки при сердечной недостаточности, риске кардиогенного шока, низком сердечном выбросе, как и при других потенциально опасных ситуациях (PR >0.24 сек, АВБ 2–3 степени, брадикардия <60 в мин, систолическое АД <100 мм рт. ст., обострение астмы или ХОБЛ) нецелесообразно. Отметим, что краткосрочная эффективность бета–блокаторов существенно ниже долгосрочного эффекта (Freemantle N. et al, 1999).
Относительными противопоказаниями к бета–блокаторам являются:, умеренная или тяжелая недостаточность левого желудочка, признаки периферической гипоперфузии, шок, интервал PR>0.24 сек, атриовентрикулярная блокада II-III степени, обострение бронхиальной астмы или ХОБЛ.
Ингибиторы ангиотензин–превращающих ферментов (ИАПФ). Всем пациентам с первых суток при отсутствии гипотензии (АДс>100 мм рт.ст.) рекомендуют назначать ИАПФ. Наиболее эффективны ИАПФ при переднем ИМ, застое в легких и систолической дисфункции левого желудочка (фракция выброса <40% по эхокардиограмме). Начинают лечение с приема каптоприла (6.25-50 мг 2 раза), зофеноприла (7.5–30 мг 2 раза) или лизиноприла (5–10 мг 1 раз). В случае непереносимости ИАПФ возможно назначение блокаторов рецепторов ангиотензина 2 (вальсатран).
Нитраты. В случае рециди
|
|
|


