 |
Кондуктометрический метод анализа
|
|
|
|
Кондуктометрический метод анализа основан на зависимости концентрации исследуемых веществ от электропроводности электролитов. Этим методом можно определять только электролиты, слабые и сильные. Электропроводность является возрастающей функцией от концентрации. В очень разбавленных (идеальных) растворах эта зависимость линейна:
χ = k·С, где χ – электропроводность раствора (каппа), К – коэффициент пропорциональности, зависящий от природы электролита, С – концентрация электролита. В концентрированных растворах зависимость более сложная и не подчиняется закону линейности.
Измерение электропроводности жидкости проводят с использованием переменного тока звуковой частоты в пределах 20–20000 Гц. В прецизионных (точных) методах применяют частоты порядка несколько тысяч Гц. В более простых устройствах применяют низкие частоты – промышленная частота 50 Гц. Кондуктометрические методы, в которых применяют большие частоты на уровне телевизионного вещания (МГц), носят название высокочастотные. Методы с использованием низких частот называют низкочастотные. Для измерений низкочастотными методами используют мосты переменного тока (мост Кольрауша).
Схема моста переменного тока (Кольрауша), работающего на промышленной частоте:
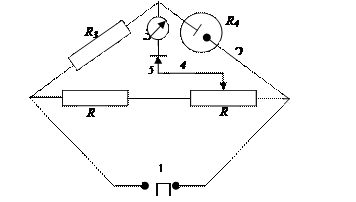 R4 – сопротивление ячейки; R3 – набор сопротивлений, позволяющих менять диапазон измерений; R1, R2 – сопротивление с точно известным значением. Мост позволяет измерять сопротивления растворов электролитов порядка 0,3–30000 Ом. Рабочая область показаний моста делится на пять пределов измерений. Чем ниже измеряемое сопротивление, тем меньше надо устанавливать сопротивление сравнительного плеча моста.
R4 – сопротивление ячейки; R3 – набор сопротивлений, позволяющих менять диапазон измерений; R1, R2 – сопротивление с точно известным значением. Мост позволяет измерять сопротивления растворов электролитов порядка 0,3–30000 Ом. Рабочая область показаний моста делится на пять пределов измерений. Чем ниже измеряемое сопротивление, тем меньше надо устанавливать сопротивление сравнительного плеча моста.
|
|
|
Отношение плеч (R1/R2) может плавно регулироваться.
Мост грубо уравновешивают вращением рукояток плеча сравнения и реохорда, а затем ставят нуль-инструмент (гальванометр постоянного тока) в положение "точно" и вращением рукоятки реохорда уравнивают мост. Погрешность измерений сопротивлений в пределах 0,3-30 Ом не превышает 5 %, а в пределах 30-3000 Ом – не более 1,5 %. Постоянный ток для определения электропроводности применять нежелательно, так как на электродах в этом случае будут проходить электродные процессы (электролиз), вызывающие электрохимическую поляризацию электродов (выделение на электродах различных продуктов электролиза). Такая поляризация искажает результаты измерений. При использовании переменного тока величина этой поляризации тем меньше, чем выше его частота, поэтому в приборах высокой точности используют высокие частоты.
Аналитические методы делят на 2 группы:
1. Прямой метод основан на непосредственном определении электропроводности раствора. Для этого готовят стандартные растворы с точно известной концентрацией и измеряют их электропроводность.
 Строят график зависимости χ от С электролита. Электропроводность сильно зависит от температуры, поэтому при проведении анализа создают условия, чтобы температура оставалась постоянной, для этого используют термостаты. При их отсутствии снимают графическую зависимость электропроводности (χ) от концентрации (С) при различных температурах, т.е. при каждой температуре получают свои изотермы. Измеряют электропроводность исследуемого раствора и по графику находят его концентрацию.
Строят график зависимости χ от С электролита. Электропроводность сильно зависит от температуры, поэтому при проведении анализа создают условия, чтобы температура оставалась постоянной, для этого используют термостаты. При их отсутствии снимают графическую зависимость электропроводности (χ) от концентрации (С) при различных температурах, т.е. при каждой температуре получают свои изотермы. Измеряют электропроводность исследуемого раствора и по графику находят его концентрацию.
В качестве прибора, где используется прямое определение электропроводности, служит солемер. С его помощью определяют плотный остаток в паровом конденсате. Его используют при анализе качества дистиллированной воды в медицине и в аналитической химии. Содержание плотного остатка в пересчете на Na2SO4 в хорошей качественной дистиллированной воде не должно превысить 5 мг/л.
|
|
|
2. Кондуктометрическое титрование используют, если исследуемые растворы окрашены и применение обычных индикаторов затруднительно, так как окраска раствора маскирует окраску индикатора. Метод основан на получении кривой зависимости электропроводности от количества прибавленного титранта. Рассмотрим три случая кондуктометрического титрования.
Титрат – вещество, которое исследуют. Титрант – это вещество, которым титруют.
1) Титрование сильной кислоты сильным основанием. Титрат – HCl, титрант –NaOH.
 1/R В точке А электропроводность максимальна, за счет полной диссоциации титранта (HCl). По мере прибавления титранта (по 0,5 мл) количество ионов Гидрогена уменьшается в результате связывания гидроксид-ионами щелочи с образованием малодиссоциирующего вещества (H2O).
1/R В точке А электропроводность максимальна, за счет полной диссоциации титранта (HCl). По мере прибавления титранта (по 0,5 мл) количество ионов Гидрогена уменьшается в результате связывания гидроксид-ионами щелочи с образованием малодиссоциирующего вещества (H2O).
HCl + NaOH = NaCl+ H2O; H+ + OH– = H2O.
Вследствие уменьшения концентрации самого подвижного иона Гидрогена (H+) электропроводность уменьшается [АЭ].
В точке эквивалентности (т.Э) все ионы Гидрогена связаны, т.е. вся кислота оттитрована и электропроводность в этой точке самая минимальная.
Эта точка при данном виде титрования выражена четко. По мере прибавления титранта на отрезке [ЭВ] увеличивается электропроводность за счет увеличения концентрации ионов ОН– (это вторые по подвижности ионы после иона Гидрогена). Этот график не симметричен. Отрезок [АЭ] более резкий, а [ЭВ] более пологий.
2) Титрование слабой кислоты сильным основанием. Титрат – CH3COOH, титрант –NaOH.
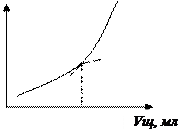 1/R В точке А электропроводность минимальна, т.к. степень диссоциации слабой кислоты менее 3 %, следовательно, ионов Гидрогена мало. На участке [АЭ] по мере прибавления титранта (щелочь по 0,5 мл) происходит реакция нейтрализации с образованием соли слабой кислоты (натрий ацетата), которая является более сильным электролитом, чем CH3COOH.
1/R В точке А электропроводность минимальна, т.к. степень диссоциации слабой кислоты менее 3 %, следовательно, ионов Гидрогена мало. На участке [АЭ] по мере прибавления титранта (щелочь по 0,5 мл) происходит реакция нейтрализации с образованием соли слабой кислоты (натрий ацетата), которая является более сильным электролитом, чем CH3COOH.
CH3COOH + NaOH = CH3COONa + H2O;
CH3COOН + Na+ + ОН– = CH3COO– + Na+ + H2O.
За счет появления этих ионов незначительно увеличивается электропроводность на участке [АЭ]. В точке Э CH3COOH полностью оттитрована. В данном случае точка эквивалентности выражена не четко и находится графически по касательным в точке перегиба. На участке [ЭВ] концентрация увеличивается за счет увеличения концентрации гидроксид ионов.
|
|
|
 3) Кондуктометрическое титрование смеси сильной и слабой кислот.
3) Кондуктометрическое титрование смеси сильной и слабой кислот.
Титрат – HCl + CH3COOH, титрант –NaOH. В точке А максимум электропроводности за счет диссоциации сильной кислоты. На участке [АЭ1] по мере прибавления щелочи титруется сильная кислота. В точке эквивалентности Э1 вся кислота HCl оттитрована и это точка соответствует объему эквивалентному Vэ1.
На участке [Э1Э2] по мере прибавления NaOH титруется слабая кислота. На этом участке электропроводность незначительно увеличивается за счет образования сильного электролита – натрий ацетата.
В точке Э2 CH3COOH полностью оттитрована и эта точка соответствует общему объему щелочи, пошедшему на титрование обеих кислот. Количество кислот рассчитываем по формулам:
υпр (HCl) = Vэ1·С(NaOH); υпр (CH3COOH) = Vэ2·С(NaOH), где Vэ2 = Vэ – Vэ1
На участке [Э2В] электропроводность увеличивается за счет накопления гидроксид-ионов.
|
|
|


