 |
Диаграмма плавления (с эвтектикой) двухкомпонентной систем. Термический анализ (кривые охлаждения)
|
|
|
|
| T a b c d t | Кривая охлаждения: Охлаждением расплав. Чистое вещество. А, число компонентов=1(к=1),с=1. Изломы на кривой свидетельствуют об изменении Ф, участок вс.: повял. первые кристаллы, Ф=2, с=0, Т не меняется Т. горизонт. уч-ка - это Т кристаллизации в-ва А. Когда жидкость закристал в системе Ф=1, с=2.Участок сd: идет охлаждение системы в тв состояние. |
| T K L M N P t | Кривая охл. двухкомпонентной системе: Система в-ва А и В-гомогенной жидкости расплав: кривая охлаждения состоит из 4х участков KL-охлаждение жидкого расплава с=2. При T TL-начнут появляться кристаллы в-ва. Т будет понижаться медленнее, т.к. при образовании кристаллов выделяется тепло. LM- охлаждение системы, состоящей из жидкого расплава и кристаллов в-ва А. |
При Т TN появляется, кристаллы вещества В. Вещества А и В не растворимы в друг друге и выделяются в виде самостоятельных твердых фазах Ф=3, с=0
MN-t-ра=const, соотв. Концу кристаллизации в-ва В. После окончания кристаллизации жидкая фаза исчезает Ф=2, с=1.
NP-охлаждение гетерогенной твердой системы. Т начало кристаллизации.
TL-для расплавов индивидуальная; TN для расплавов всех конц соств температуре эвтетике.
15.Взаимонерасворимые жидкости. Теоритические перегонки с водяным паром
Такие системы образуют два слоя и могут быть разделены путем отстаивания.
Система, состоящая из двух 9нерастворимых компонентов и 3-х фаз (2-х жидких и одной паровой) имеет согласно правилу фаз, одну степень свободы. Отсюда следует, что каждой T смеси отвечает строго определенное давление, и каждый компонент смеси ведет себя независимо от друга Соответственно, парциальное давление каждого компонента не зав-т от его содержания в смеси и равно давлению паров чистого компонента при той же температуре.
|
|
|
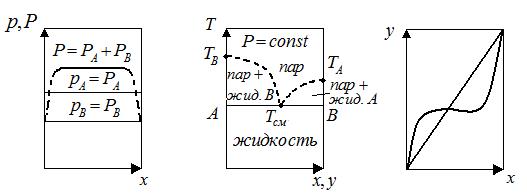
Фазовые диаграммы смесей взаимонерастворимых жидкостей. Как видно из диаграммы p-x:  ,
,  (3.9)
(3.9)
В диаграмме T-x,y: TA- температура кипения чистого компонента А, TB- температура кипения чистого
компонента В, Tсм- температура кипения смеси. Tсм- температура кипения смеси (А+В), как видно из рис.не зависти от состава смеси (АВ-горизонтальная линия). Характерно, что температура кипения смеси Tсм всегда ниже температуры кипения чистых компонентов, составляющих смесь.
Для взаимно нерастворимых жидкостей состав пара над кипящей смесью постоянен и не зависит от соотношения компонентов в растворе. По закону Дальтона имеем: yA=PA / P, yB=PB / P
Перегонка с водяным паром - наиболее распространенный способ получения эфирного масла. Его применяют в случаях, когда сырье содержит сравнительно много эфирного масла и температура перегонки (около 100 °С) не отражается на качестве готового продукта.
Теоретические основы процесса перегонки с водяным паром подчиняются закону Дальтона о парциальных давлениях, согласно которому смесь жидкостей (взаимно нерастворимых и химически друг на друга не действующих) закипает тогда, когда сумма упругостей их паров достигает атмосферного давления.
По закону Дальтона общее давление смеси равно сумме парциальных давлений компонентов. В результате давление паров смеси достигает атмосферного давления еще до кипения воды. Так, например, смесь пихтового масла и воды при атмосферном давлении будет перегоняться при температуре 95,5°С (вместо 160°С для пинена - основного компонента пихтового масла).
Перегонку с водяным паром осуществляют в перегонных аппаратах непрерывного или периодического действия, перегонных аппаратах контейнерного типа и др.
|
|
|
16. Трехкомпонентные системы. Закон распределения в-в между двумя несмешивающимися жидкостями. Коэффициент распределения. Принцип получения настоек, отваров. Экстракция.
Жидкие 3-х компонентные системы включают 2 несмешивающихся жидкости и распределяемый между ними 3-й компонент будет распределен до установления равновесия.
Закон распределения: При t=const отношения концентрации 3х компонента в двух равновесных жидких фазах яв-ся вымышленной постоянной. К=СЗ1/ СЗ2где к-коэффициент распределения, зависит от t и p.
Закон выполнения при условия:
1) Конц 3 компонента не велика.
2) Не происходит диссоциация или ассоциация частиц 3 компонента.
3) 3 компонент не влияет на взаимную р-ть в жидкости.
Коэффициент распределения -это равновесное отношение концентрации элемента в одной фазе к его концентрации в другой фазе, например в системе из двух несмешивающихся жидкостей, которая может быть больше или меньше единицы.
Экстракция -это процесс извлечения вещества, растворенного в одном растворителе, другим растворителем, который не смешивается с первым и лучше растворяет извлекаемое вещество.
Количественно экстракцию оценивают параметром-степенью извлечения 
n0-кол-во извлеченного,nв-кол-во в-ва, оставшегося в водной фазе
Соединение, ответственное за образование экстрагируемого соединения, называется экстрагентом. Органическую фазу, отделенную от водной фазы и содержащую экстрагированные соединения, называют экстрактом. При однократной экстракции экстрагент в одном приеме добавляется к водной фазе.
Многократная экстракция эффективней однократной. Однако она характеризуется большей трудоемкостью и большими энергозатратами.
Непрерывная экстракция - осуществляется при непрерывном и относительном перемещении двух фаз.
В противоточной экстракции -не смешивающихся фазы непрерывного двигаются навстречу друг другу
Для приготовления отваров и настоев измельченное сырье помещают в предварительно прогретую в течение 15 минут на кипящей водяной бане инфундирку или сосуд для настаивания и заливают рассчитанным количеством воды очищенной комнатной температуры. Время настаивания вытяжки на кипящей водяной бане для настоев составляет 15 минут, для отваров - 30 минут. Затем вытяжку снимают с водяной бани и охлаждают при комнатной температуре, продолжая тем самым процесс экстракции действующих веществ. Для настоев это время составляет 45 минут, для отваров - 10 минут. В случае приготовления водных извлечений объемом более 1000 мл время настаивания на кипящей водяной бане и при комнатной температуре должно быть увеличено на 10-20 минут в зависимости от объема.
Согласно требованиям ГФ XI издания, при отсутствии указаний о количестве лекарственного растительного сырья настои и отвары следует готовить в соотношении 1: 10; из травы горицвета, корней истода, корней и корневищ валерианы, цветков, травы, листьев ландыша, семян льна следует готовить вытяжки в соотношении 1: 30; из травы душицы, плодов шиповника, корней алтея - в соотношении 1: 20. Настои и отвары из сырья, содержащего сильнодействующие вещества - травы наперстянки и термопсиса необходимо готовить вытяжки в соотношении 1: 400. Приготовленные таким образом вытяжки следует принимать в небольших количествах, объемом 10-15 мл на прием (одна десертная или столовая ложка). Принцип приготовления «настоев» и «отваров» разведением концентрированных извлечений получил широкое признание в фармакопеях, причем в качестве исходных препаратов в разных странах используются различные продукты, начиная с настоек, жидких и сухих экстрактов и кончая специально приготовленными «концентратами».
|
|
|
18.Осмотические свойства растворов электролитов. Изотонический коэффициент
Изотонический коэффициент -(i)- безразмерный параметр, хар-ся поведение в-ва в растворе.
Найденные Вант-Гоффом значения i для растворов солей, кислот, оснований имеют разные значения, зависящие от природы и концентрации растворителя, и изменяются от 1 до 4.
Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства не электролита той же концентрации при неизменных прочих параметрах системы:
Осмотическое давление разбавленных растворов
Растворенное вещество по поведению во многих отношениях похоже на газ. Так, растворенное вещество, как и газ, стремится равномерно распределиться по всему объему раствора. Если неокрашенный растворитель привести в соприкосновение с окрашенным раствором, то вы увидите, что растворенное в-во проникает в неокрашенную жидкость (раст-ль). Происходит диффузия – переход молекул растворенного в-ва через поверхность раздела в раст-ль и одновременно молекул растворителя в раствор. Такая встречная, двухсторонняя диффузия растворенного вещества и растворителя продолжается до тех пор, пока система не придет в состояние равновесия или пока энтропия системы не станет максимальной. Можно сделать диффузию односторонней, разделив некоторый раствор и растворитель полупроницаемой перегородкой (мембраной), проницаемой для молекул растворителя и непроницаемой для молекул растворенного вещества.
Явление самопроизвольного перехода растворителя через полупроницаемую перегородку в раствор называется осмосом.
Pосм зависит от концентрации раст-ого в-ва и Т. Так, при увеличении концентрации с сахарозы в воде в два раза осмотическое давление возрастает примерно в два раза, при увеличении концентрации c в три раза осмотическое давление возрастает почти во столько же и т. д. Это можно записать следующим образом: ~ с, где с – мольная (молярная) концентрация (для точных измерений пользуются моляльной концентрацией).
Осмотическое давление идеальных растворов линейно зависит от температуры и молярной концентрации раствора С и может быть рассчитано по уравнению Вант-Гоффа: осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор.
|
|
|
19.Криометрический, эбулиометрический и осмометрический методы определения молярных масс, изотонического коэффициента.
Криоскопический метод используют в фармации для определения молярных масс новых ЛВ, а так же для оценки изотонической концентрации. Сущность определения изотонической концентрации сводится к определению ∆Т лекарственного раствора. Найденная ∆Т должна быть такой же, как для жидкостей организма.
Осмотический метод применяют в основном для определения молярной массы высокомолекулярных соединений (белков, полисахаридов и т.д.) Для этого достаточно измерить осмотическое давление р-ра известной концентрации.
ЭБУЛИОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ МОЛЕКУЛЯРНОГО ВЕСА ВЕЩЕСТВА
Подобное равновесие можно установить методом криометрии. Указать методы определения молекулярного веса не электролитов и степени диссоциации слабых электролитов, основанные на свойствах разбавленных растворов. Правило фаз широко используется в методах физико-химического анализа, который устанавливает зависимость между изучаемым физическим свойством и составом системы. Это отличает анализ диаграмм состояния от препаративного метода исследования.
|
|
|
20.Теория растворов сильных электролитов Деббая-Хюккеля. Ионная атмосфера. Активность ионов и ее связь с конц-ей. Ионная сила р-ра. Коэффициент акт-ти и зависимость его величины от ионной силы в р-ре.
Теория р-в сильных электролитов: сильные электролиты диссоциируют практически необратимо, что приводит к ↑ концентрации ионов и возрастает межионные взаим-ия. Ионы одного знака окружаются ионнами другого знака.
Уравнение Дебая-Хюккеля: 
Ионная атмосфера- повышенная концентрация ионов противоположного знака в объёме, окружающем данный ион в растворе (образуется вследствие действия электрического поля, создаваемого этим ионом)
Активность (ионов) — эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую величину. Отношение активности (а) к концентрации вещества в растворе (с, в г-ион/л) называется коэффициентом активности: γ = a/c.
Ионная сила раствора - это мера интенсивности электрического поля, создаваемого ионами в растворе
 Коэффициент активности - показатель отклонения поведения раствора от идеального, выраженный отношением его активности к концентрации. С увеличение ионной силы раствора коэффициент активности уменьшается. Однако, достигнув определенного минимального значения, коэффициент активности при дальнейшем увеличении ионной силы возрастает.
Коэффициент активности - показатель отклонения поведения раствора от идеального, выраженный отношением его активности к концентрации. С увеличение ионной силы раствора коэффициент активности уменьшается. Однако, достигнув определенного минимального значения, коэффициент активности при дальнейшем увеличении ионной силы возрастает.
21. Буферные растворы(лекция с инета).
Буферные растворы - это растворы с определенной устойчивой концентрацией водородных ионов (смесь слабой к-ты с сопряженным основанием, например CH3COOH и CH3COONa – ацетатный буфер или слабого основания и сопряженной к-ты, например NH3 и NH4Cl- аммиачный буфер). Величина рН буферного раствора может, изменяется при добавлении небольших количеств свободной сильной кислоты или жидкости, при разбавлении или концентрировании.
Механизм действия буферной системы рассмотрим на примере аммиачной буферной системы: NН4ОН (NН3 х Н2О) + NН4С1.
Гидроксид аммония - слабый электролит, в растворе частично диссоциирует на ионы:
NН4ОН <=> NН4+ + ОН-
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы NН4С1 → NН4+ + С1- и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции. Поэтому С (NН4ОН) ≈ С (основания); а С (NН4+) ≈ С (соли).Если в буферном растворе С (NН4ОН) = С (NН4С1), то рН = 14 - рКосн. = 14 + lg 1,8.10-5 = 9,25.
Фосфатная буферная система -содержится в крови=1%, в клетках жидкости др. тканей и особенно много в почках.
Состоит из дигидрофосфата к-ты (Н2РО4-) и гидрофосфата основание (НРО4 2-)
Механизм действия:
Н+ + НРО4 2- ↔ Н2РО4 –
ОН - + Н2РО4 ↔ НРО4 2- + Н2О
В клетке-калиевые фосфаты
В плазме-натриевые фосфаты
Гемоглобиновый б.с. - сложная б.с. эритроцитов, которая включает в качестве донора протона 2 слабые кислоты: гемоглобиновая и оксигемоглобиновая.
Чем больше рКа, тем слабее к-та:
рКа (ННВ)=8.20<рКа (ННвО2)=6.95
Механизм действия:
Т.к. ННвО2 сильнее ННв, то Н+ в первую очередь будет взаимодействовать с Нв-:
1) Н+ + Нв-↔ННв
2)Н+ +НвО2-↔ННвО2↔ННв+О2
· ОН - +ННвО2↔НвО2-+Н2О
· ОН -+ННв↔Нв -+Н2О
Буферная емкость - равна числу моль экв сильной к-ты или щелочи, которую нужно добавить к 1 л буферного раствора, чтобы изменить его рН на 1.


Буферная емкость зависит от:
1) Концентрации компонента, чем больше С, тем больше б.ё.
2) Соотношение концентрации компоненов Вmax при Ск-ты=Ссоли, рН=рК
3) рН
22.Удельная и молярная электропроводности, их зависимость от концентрации р-ра. Законы Кольрауца. Подвижность и гидратация (сольвация) ионов.
Удельная электропроводность -физ величина, равная электропроводности целиндрического проводника единичной длины и единица площади поперечного сечения.
Молярная электропроводность - электрическая проводимость плоского слоя электролита толщиной 1 см, содержащего 1 моль растворенняого вещества.(ʎ=1000*к/с) - удельная электропроводность
Молярная электропроводность при бесконечном разведении равна сумме электрических подвижностей катиона и аниона данного электролита.
Закон Кольрауса: в бесконечно разбавленном р-ре перенос электричества осуществляется всеми ионами независимо друг от друга. При этом общая молярная электропроводность р-ра равна сумме молярных электропроводностей отдельных ионов.
ʎю=V+ʎю+ +V-ʎю-
Подвижность ионов в р-х (U=Fu)-скорость иона в см/сек при напряженности электрического поля в 1 в/см. Величина И зависит от природы иона, от t, диэлектрической проницаемости, вязкости и конц р-ра.
1. ионизация металла пластинки, где в узлах кристаллической решетки находятся ионы-атомы, Ме↔Меn+ + ne-. Ионизация происходит под действием полярных молекул р-ля (воды). Образ при этом ионы концентрируются на пластинке, заряжая ее отрицательно, а образ катионы Ме+ переходят с пластинки в р-р и концентрируются возле пластинки.
2. Взаимодействие молекул р-ля с ионами Ме+, т.е. сольвация: Меn+ +m H2O↔Me n+ * mH2O
Me Уравнение Нернста:  *
* 
ℓ( =
=  +2,3RT/Z*F* lga(Mez+)
+2,3RT/Z*F* lga(Mez+)
| Стандартный электродный потенциал (Е0 )- является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии к-ое осуществляется в р-х при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100кПа. |
24. Классификация электродов. Стандартный водородный электрод. Хлорсеребрянный электрод. Изменение электродных потенциалов. Концентрационные гальванические элементы. Химические источники тока. Классификация:
1) Электроды первого рода: состоят из металлической пластинки, погруженной в р-р соли того же Ме+
2) Электроды второго рода явл электроды, в к-х Ме+ покрыт малорастворимой солью этого Ме+ и находится в р-ре содержащем др. растворимую соль с тем же анионом.
Стандартный водородный электрод -электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод представляет собой пластинку или проволоку из металла, хорошо поглощаемую газообразный водород, насыщенную водородом и погруженную в водный раствор, содержащий ионы водорода.
Хлорсеребряный электрод - представляет собой серебряную пластинку или проволоку, покрытую слоем малорастворенной соли серебра (хлорида) и опущенный в р-р хлорида калия.
Концентрационный элемент - это гальванический элемент, состоящий из двух одинаковых металлических электродов, опущенных в р-ры соли Ме+ с различными концентрациями С1>С2
Химические источники тока - устройства, вырабатывающие электрическую энергию за счет прямого преобразования хим. энергии ОВР.
25.ОВР потенциалы. Механизм возникновения. ОВ электроды. Стандартный Ов потенциал.
ОВ электроды- системы, состоящие из инертного Ме+(Pt) и раствора, содержащего окислитель и восстановительную форму одного и того же элемента. Обозначается: Pt/Ox/Red
Уравнение Нернста- Петриса: ℓок./вос=ℓ0ок/вос+2.3RT/nF lg a(ок.)/а (вос), где n-число е
ОВ электроды - простые и сложные
Простые - Электродная реакция приводит к изменению степени ок-ля без изменения состава.
Сложные - Электродная реакция протекает с изменением степени ок-ля реагирующих частиц и их с-ва.
Стандартный ОВ- потенциал - представляет собой электродвижущую силу гальванического элемента, составленного из ОВ-электрода, в к-м активности (концентраций) ок-й и вос-й форм в-ва равны 1моль/л, и нормального водородного электрода.
26.Ионоселективные электроды. Стеклянный электрод. Другие виды ионоселективных электродов. Применение в биологии, медицине, фармации.
Ионоселективные электроды -электрохимические электроды, равновесный потенциал к-х в р0ре электролита, содержащем определенные ионы, обратимо и избирательно зависит от концентрации этих ионов (в большинстве случаев ионоселективный электрод представляет собой устройство, осн. элементом к-го явл мембрана, проницаемая только для определенного иона)
Используют для опред конц (активности) разл ионов в р-ре, а так же для анализа и контроля процессов, протекания к-х сопровождается изменением ионного состава р-в.
Стеклянный электрод обозначается Ag / AgCl / HCl. Электрод представляет собой тонкостенный шарик из специального токопроводящего стекла (мембраны), наполненный р-м HCl конц 0.1 моль/л. В р-р нее погружен вспомогательный хлорсеребряный электрод.
В зависимости от типа мембраны ионоселективные электроды можно разделить на следующие группы:
твердые электроды — гомогенные, гетерогенные, на основе ионообменных смол, стекол, осадков, моно- и поликристаллов;
жидкостные электроды на основе жидких ионитов хелатов — нейтральные переносчики биологически активных веществ;
газовые и энзимные электроды.
27. Потенциометрический метод измерения рН. Потенциометрическое титрование. Значение этих методов в фармацевтической практике.
Потенциометрические методы анализа, основанный на выявлении эквивалентного соотношения реагирующих в-в путем измерения ОВ потенциала исследуемой системы, наз. потенциометрическим титрованием.
Потенциометрический метод определения водородного показателя рН
Потенциометрический анализ - это один из электромеханических методов анализа, основанный на определении концентрации иона по электродвижущей силе (ЭДС) гальванического элемента. Гальванический элемент состоит из двух электродов, а ЭДС его представляет собой разность потенциалов этих электродов. Для потенциометрического анализа используют гальванические элементы, состоящие из измерительного электрода и электрода сравнения. Потенциал первого зависит от концентрации определяемого иона в растворе, а потенциал второго не чувствителен к концентрации этого иона. Изменение потенциала измерительного электрода по отношению к потенциалу электрода сравнения линейно зависит от логарифма концентрации измеряемого иона. Потенциометрия широко применяется для определения концентрации водородных ионов растворов.
В качестве измерительных электродов в настоящее время применяются преимущественно стеклянные электроды. Они обычно представляют собой стеклянную трубку с шаровым расширением на нижнем конце, заполненную раствором с постоянным рН (0,1М - раствор соляной кислоты), в который погружен вспомогательный электрод. В шарообразной части трубки стекло имеет очень малую толщину и может действовать как мембрана. По своему принципу действия стеклянный электрод подобен ионообменнику. Главную роль здесь играют процессы обмена между ионами Na+, входящими в состав стекла, и ионами H- раствора вблизи поверхности стекла. Возникновение пограничного потенциала на границе стекло-раствор при погружении электрода объясняется тем, что ионы водорода из раствора проникают в поверхностные слои стекла, замещают там ионы натрия, вследствие чего стеклянный электрод приобретает потенциал, зависящий от величины рН контролируемого раствора.
Стеклянные электроды пригодны для измерения рН во всем диапазоне и обеспечивают при этом высокую точность. Недостатками стеклянных электродов являются их хрупкость и высокое внутреннее сопротивление.
28. Скорость хим. реакции, порядок р-ии по в-ву, общий порядок р-ии, молекулярность р-ии. Закон действующих масс для скорости рии.
Скорость р-ии - опр количеством в-ва, прореагировавшего в единицу времени в единицу обьема: Vi=dci/dt
Скорость реакции зависит от природы реагирующих в-в,температуры, наличия катализатора, концентрации и т.д.
Закон действующих масс (для кинетики) р-ии подразделяются на простые (элементарные, идущие в 1 стадию), сложные (многостадийные)
Зако́н действующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Закон действующих масс в химической кинетике, выражающий зависимость скорости реакции от концентраций реагирующих веществ: при постоянной температуре скорость химической реакции в данный момент пропорциональна произведению молярных концентраций реагирующих веществ. Для простой тримолекулярной реакции
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:

 .где
.где  — скорость химической реакции,
— скорость химической реакции,  — константа скорости реакции.
— константа скорости реакции.
Простые р-ии: кол-ная зависимость Vр-ии от С выражается в основном постулатом хим кинетики V=k[A] nA* [B]nB, к-const скорости хим. р-ии, nA,nB-показатель степени
ПОРЯДОК РЕАКЦИИ — по данному веществу показатель степени при концентрации этого вещества в кинетическом уравнении химической реакции. Суммарный порядок реакции слагается из порядков реакции по всем веществам, концентрации которых входят в кинетическое уравнение
Общий порядок реакции (второй) равен сумме стехиометрических коэффициентов в уравнении скорости реакции.
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности различают реакции:
1) мономолекулярные; 2) бимолекулярные; 3) тримолекулярные.
29.Зависимость скорости реакции от различных факторов. Реакции простые (одностадийные) и сложные (многостадийные), гомогенные и гетерогенные. Скорость гомогенных хим. реакций и методы ее измерения.
Факторы, влияющие на скорость химических реакций
1. Природа реагирующих веществ
Под "природой реагирующих веществ" понимают:
1. Для веществ молекулярного строения – тип химических связей в молекулах реагентов, прочность связей. Чтобы молекула прореагировала, связь в ней необходимо разорвать.
2. Для веществ немолекулярного строения (ионный или атомный кристалл) – строение кристаллической решетки, ее прочность.
3. Для веществ, у которых "молекула" состоит из одного атома (например, металлы, благородные газы) – строение электронной оболочки атома, прочность связывания внешних электронов. 4. Для молекул сложной формы – вероятность благоприятного для реакции взаимного расположения реагентов при соударении.
2. Концентрация реагентов
Чтобы вещества прореагировали, необходимо, чтобы их молекулы столкнулись. Вероятность столкновения двух людей на ожив-ленной улице гораздо выше, чем на пустынной. Так и с молекулами.. Она прямо пропорциональна количеству молекул реагентов в единице объема, т.е. молярным концентрациям реагентов.
3. Давление
Давление влияет на скорость реакций с участием газов, потому что оно непосредственно определяет их концентрации
Из уравнения Менделеева-Клапейрона pV = nRT следует, что с = р. / RT, т.е. давление и молярная концентрация газа связаны прямо пропорционально. Поэтому в закон действующих масс мы можем подставлять вместо концентрации давление.
4. Температура.
Влияние температуры на скорость реакции отражено в правиле Вант-Гоффа:
При повышении температуры на каждые 10 градусов скорость большинства химических реакций возрастает в 2–4 раза: U2/U1=ℓ T2/T1/10, где – температурный коэффициент скорости химической реакции, показывающий, во сколько раз увеличивается скорость реакции при увеличении температуры на каждые 10 градусов; υ1, υ2 – скорости реакции при температурах Т1 и Т2
5. Влияние величины поверхности соприкосновения реагирующих веществ
Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ – путем их растворения.
6. Влияние катализатора
Катализ – явление изменения скорости химической реакции веществами, которые участвуют в реакции, но не входят в со - став конечных продуктов.
К простым относятся реакции, которые протекают только в одну стадию.
Реакции, при протекании которых осуществляются разнотипные элементарные акты, называются сложными реакциями. Сложные реакции в свою очередь делят на последовательные, параллельные и сопряженные.
Гомогенные реакции – протекают при отсутствии поверхности раздела между реагентами по всему объему системы, т.е. в пределах одной фазы, например в смеси газов или веществ в растворе. Примером гомогенной реакции в газовой фазе может служить взаимодействие водорода и йода с образованием йодоводорода: H2(г) + I2 (г) = 2HI(г). Примером гомогенной реакции в растворе является: NaOH(р-р) + HCl(р-р) NaCl(р-р) + Н2О (ж)
Гетерогенные реакции – протекают на границе раздела фаз между реагентами, поэтому скорость гетерогенной реакции зависит от концентрации подвижного компонента (газа, растворенного вещества), от площади поверхности раздела фаз, от скорости диффузии подвижного компонента в зону реакции, а продуктов реакции – из этой зоны.
Скорость гетерогенной реакции – это количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности фазы:  Важнейшие факторы, влияющие на скорость химической реакции, – природа и концентрация реагентов, температура, присутствие катализатора. Из определения скорости реакции следует, что она имеет размерность: [концентрация]/[время]–1. В химической кинетике концентрацию чаще всего выражают в моль/л, а время – в секундах. Отсюда скорость химической реакции выражается в моль/л–1с–1.
Важнейшие факторы, влияющие на скорость химической реакции, – природа и концентрация реагентов, температура, присутствие катализатора. Из определения скорости реакции следует, что она имеет размерность: [концентрация]/[время]–1. В химической кинетике концентрацию чаще всего выражают в моль/л, а время – в секундах. Отсюда скорость химической реакции выражается в моль/л–1с–1.

30.Уранения кинетики реакций нулевого, первого, второго порядка. Период полупревращения.
Период полупревращения- это время, необходимое для того, чтобы исходная концентрация реагента уменьшилась вдвое. ДОПИСАТЬ С ТЕТРАДИ
31. Методы определения порядка р-ии:
1. Интегральные методы:
-метод подстановки (он заключается в экспериментальном определении концентрации в-ва в различные моменты времени)
-графический метод (экспериментально измерив конц в-ва в различные интервалы времени от начала р-ии, строят графики, выражающие зависимость lnc, 1/c от времени)
-определение порядка по периоду полупревращения(для определения порядка р-ии достаточно экспериментально определить время полупревращения для нескольких начальных конц и установить, какая зависимость существует между ними.
2.Дифференциальные методы:
Метод Вант-Гофа - дифференциальный метод заключается в определении тангенса угла наклона экспериментально полученной логарифмической зависимости скорости р-и от концентрации
32.Энергия активации. Связь между скоростью реакции и энергией активации. Метод определения энергии активации
Энергия активации(Еа)- min избыточная энергия, к-й должны обладать взаимодействующие частицы, чтобы вступить в хим взаимодействие.
Зависит от природы, пути протекания р-ии. На основе правила Вант-Гоффа разработан метод ускоренного старения мк формы для определения срока ее годности.
Повышение t позволяет увеличить скорость разложения ЛП в 10 раз и более по сравнению с ее значением при комнатной t.
Срок годности- это интервал времени, в течении к-го кол-во в-ва в ЛП уменьшается на 10%
Методы определения энергии активации:
1. по экспериментальным значениям константы скорости р-ии:  A=lnK0
A=lnK0
2. Аналитический метод: Е=-R* dlnK/d(1/T)
33.Сопряженные р-ии: конкурирующие(параллельные), последовательные, сопряженные и обратимые. Превращение лек. В-ва в организме как совокупность последовательных процессов, константа всасывания и константа элиминации.
Конкурирующие(параллельные р-ии): Параллельные р-ями называется р-ии, в к-х исходные в-ва одновременно реагируют в нескольких направлениях.
А ка В V=(Kв+Кс) [А]
кс С
Сопряженные р-ии: называются две р-ии, к-х одна может протекать только совместно с другой А+В->М и А+С=Д
Обратимые р-ии: р-ии, протекающие одновременно в двух противоположных направления, называются обратимыми А↔В
Последовательные р-ии: возникают тогда, когда продукт первой р-ии становится исходным в-м для дальнейших превращений А-В-С
34. Цепные р-ии. Фотохимические р-ии. Закон фотохимической эквивалентности Эйнштейна. Квантовый выход р-ии.
Цепные р-ии -называются р-ии, протекающие через ряд регулярно повторяющихся элементарных р-й, с участием свободных радикалов.
Фотохимические реакции- это р-ии, к-е осуществляются под действием видимого или ультрафиолетового света. Закон: каждый поглощаемый фотон вызывает одну элементарную р-ю. Е=NhV-Nh *C/ʎ
(V-частота излучения, С-скорость света, ʎ-длина световой волны, h- постоянная Планка)
Квантовый выход р-ии -отношение числа химически измененных молекул к числу поглощаемых квантов световой энергии
∂=nхим/na=nхим/QhV где nхим-число химических измененных молекул.
35.каталитические процессы. Положительный и отрицательный катализ. Гомогенный катализ. Механизм действия катализатора. Энергия активации каталитических реакций. Кислотно-основный катализ. Металлокомплексный катализ, ферментативный катализ. Механизм действия ингибиторов.
Катализом называют явление изменения скорости реакции в присутствии катализаторов.Реакции протекающие с участием катализаторов называют каталитическими. Вещества которые увел скорость хим рции, оставаясь при этом в результате суммарной рции в неизменном количестве, назыв катализаторами.
Механизм действия катализатора:
1. катализатор активно учавствует в элементарном акте реакции, образуя либо промежуточное соединение с одним из участков реакции, либо активированный комплекс со всеми реагирующими веществами
2. Скорость реагирующей реакции пропорциональна кол-ву катализатора
3. катализатор обладает избирательностью р-я. Он может влиять на скорость одной реакции не влияя на другую.
4. катализатор дает р-ии возм-ть протекать по другому пути, причем с большей скоростью, чем это происходит в присут. катализатора
5. катализатор не влияет на положение термодинамического равновесия
6. при добавлении некоторых веществ, называемых промоторами, активность катализатора растет, ингибиторов уменьшает скорость реакции.
Гомогенный катализ. В гомогенном катализе катализатор представляет собой молекулу или ион, находящийся в гомогенном растворе. В случае гомог. катлиза катализатор и все реагирующие в-ва составляют одну общую фазу.
Ферментативный катализ. Практически все биохимические реакции как у простейших одноклеточных, так и у высших – животных и растений, носят каталитический характер. В качестве катализаторов этих биохимический реакций выступают вещества белковой природы, вырабатываемые клетками живых организмов, – ферменты. Ферменты часто называют биологическими катализаторами
36.Поверхностная энергия Гиббс


