 |
Электронное строение и физико-химические свойства спиртов.
|
|
|
|
Спирты,
Синтез этилового эфира 4-бромбенозойной кислоты
Курсовая работа
Выполнил студент____курса, _____группы_______________________
(фамилия, имя, отчество)
__________________________
Научный руководитель___________________________
(ученая степень, ученое звание)
___________________________
(фамилия, инициалы)
___________________________
Работа защищена«___»________________200_г.
Оценка____________________
Зав. кафедрой___________________________
(ученая степень, ученое звание)
___________________________
(фамилия, инициалы)
___________________________
САМАРА 200__
Содержание:
1) Введение………………………………………………………………….…3
2) Литературный обзор……………………………………………………….4
2.1) Электронное строение и физико-химические свойства спиртов……….4
2.2) Химические свойства спиртов……………………………………………..7
3) Обсуждение результатов………………………………………………....13
4) Экспериментальная часть………………………………………………..15
5) Выводы………………………………………………………………….....16
6) Список литературы……………………………………………………....17
Введение
Цель работы состоит в составление литературного обзора по спиртам и синтеза этилового эфира 4-бромбензойной кислоты.
Спиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединенных с радикалом. Они могут рассматриваться, поэтому как производные углеводородов, в молекулах которых один или несколько атомов водорода заменены на гидроксильные группы.
В зависимости от числа гидроксильных групп спирты подразделяются на одно-, двух-, трехатомные и т. д. Двухатомные спирты часто называют гликолями по названию простейшего представителя этой группы – этиленгликоля (или просто гликоля). Спирты, содержащие большее количество гидроксильных групп, обычно объединяют общим названием многоатомные спирты.
|
|
|
Область применения спиртов обширна. Спирты – древесный, винный и сивушные масла – служили источником для производства ациклических соединений. Простейшие спирты применяются как растворители в лакокрасочном производстве, а высшие спирты, начиная с бутилового, - в виде эфиров фталевой, себациновой и других двухосновных кислот – как пластификаторы.
Из метанола получают формальдегид, из которого готовятся синтетические смолы, используемые в производстве феноло-формальдегидных пластических материалов, служит полупродуктом для производства многих красителей, фармацевтических препаратов, душистых и др. веществ.
Литературный обзор
Электронное строение и физико-химические свойства спиртов.
Пространственное и электронное строение, длины связей и валентные углы в спирте приведены ниже.
 |
Валентные углы в 109о и 110о указывают на sp3-гибридизацию атома углерода, две не поделенные пары электронов кислорода расположены на sp3-гибридных орбиталях. По сравнению с водой первые потенциалы ионизации спиртов заметно ниже, что указывает на большую доступность НЭП атома кислорода спирта в химической реакции.




Замена атома водорода гидроксигруппы на алкильную группу у атома кислорода и увеличение алкильной группы отчетливо снижает первый потенциал ионизации спирта, повышая при этом его электродонорные свойства. Молекула спирта в общем характеризуется 3 реакционными центрами:  1) О-Н - связь: реакция с разрывом О-Н – связи определяют кислотность спирта; 2) НЭП атома кислорода определяет основность и нуклеофильность молекулы спирта; 3) С-О – связь: Разрыв этой связи характерен для реакции нуклеофильного замещения.
1) О-Н - связь: реакция с разрывом О-Н – связи определяют кислотность спирта; 2) НЭП атома кислорода определяет основность и нуклеофильность молекулы спирта; 3) С-О – связь: Разрыв этой связи характерен для реакции нуклеофильного замещения.
Физические свойства спиртов существенно зависят от строения углеводородного радикала и положения гидроксильной группы. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества.
|
|
|
Метанол, этанол и пропанол смешиваются с водой во всех соотношениях. С ростом молекулярной массы растворимость спиртов в воде резко падает, так, начиная с гексилового, одноатомные спирты практически нерастворимы. Высшие спирты не растворимы в воде. Растворимость спиртов с разветвленной структурой выше, чем у спиртов с имеющих неразветвленное, нормальное строение. Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и часто неприятный. Высшие спирты практически не имеют запаха. Третичные спирты обладают особым характерным запахом плесени.
Низшие гликоли – вязкие бесцветные жидкости, не имеющие запаха; хорошо растворимы в воде и этаноле, обладают сладким вкусом.
С введением в молекулу второй гидроксильной группы происходит повышение относительной плотности и температуры кипения спиртов. Например, плотность этиленгликоля при 0°С – 1,13, а этилового спирта – 0,81.
Спирты обладают аномально высокими температурами кипения по сравнению со многими классами органических соединений и чем можно ожидать на основании их молекулярных весов (Табл.1).
Таблица 1.
Физические свойства спиртов.
| Отдельные представители | Физические свойства | ||
| название | структурная формула | т. пл., °С | т. кип., °С |
| Одноатомные | |||
| Метанол (метиловый) | СН3ОН | -97 | 64,5 |
| Этанол (этиловый) | СН3СН2ОН | -115 | 78 |
| Двухатомные | |||
| Этандиол-1,2 (этиленгликоль) | НОСН2СН2ОН | -17 | 199 |
| Трехатомные | |||
| Пропантриол-1,2,3 (глицерин) | НОСН2СН(ОН)СН2ОН | 20 | 290 |
Это объясняется особенностями строения спиртов – с образованием межмолекулярных водородных связей по схеме:

Спирты разветвленной структуры кипят ниже, чем нормальные спирты того же молекулярного веса; первичные спирты кипят выше вторичных и третичных их изомеров.
Способы получения:
1) Гидротация алкенов
Алкены присоединяют воду в присутствие кислот  или гетерогеного катализатора (например
или гетерогеного катализатора (например  )
)

2) Гидроборирование алкенов:
Гидроборирование алкенов и последующее окисление ведут к получению спиртов. При этом присоединение гидроксигруппы идет против правила Марковникова. Реакция протекает по двойной углерод-углеродной связи:
|
|
|

3) Гидролиз галогенпроизводных алканов:
Дейтсвием водны или растворов щелочи многие галогенпроизводные образуют спирты

4)Взаимодействие реактивов Гриньяра с карбонильными соединениями:
Синтезы на основе реактивов Гриньяра или литийорганических соединений
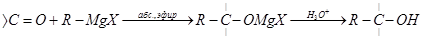
5) Восстановление карбонильных соединений:
Альдегиды, кетоны, сложные эфиры карбоновых кислот хорошо восстанавливаются до спиртов






Сложные эфиры восстанавливают так же по реакции Буво-Блана, нагревая их с натрием в этаноле



|
|
|
12 |


