 |
Дегидратация спиртов (отщепление воды).
|
|
|
|
В зависимости от условий дегидратации образуются олефины или простые эфиры.
Олефины (этиленовые углеводороды) образуются при нагревании спирта (кроме метилового) с избытком концентрированной серной кислоты, а также при пропускании паров спирта над окисью алюминия при 350° - 450°. При этом происходит внутримолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от одной и той же молекулы спирта, например:
|


 СН2 – СН2
СН2 – СН2  СН2 = СН2 + Н2О или
СН2 = СН2 + Н2О или
|
 СН3-СН2-СН2ОН СН3-СН=СН2+Н2О
СН3-СН2-СН2ОН СН3-СН=СН2+Н2О
Простые эфиры образуются при осторожном нагревании избытка спирта с концентрированной серной кислотой. В этом случае происходит межмолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от гидроксильных групп разных молекул спирта, как это показано на схеме:
|
|
 R – O – R + H2O
R – O – R + H2O
|
 2С2Н5ОН С2Н5-О-С2Н5+Н2О
2С2Н5ОН С2Н5-О-С2Н5+Н2О
Первичные спирты дегидратируются труднее вторичных, легче отнимается молекула воды от третичных спиртов [5].
Дегидрогенизация спиртов и окисление.
Образование разных продуктов в реакциях дегидрогенизации и окисления является важнейшим свойством, позволяющим отличить первичные, вторичные и третичные спирты.
При пропускании паров первичного или вторичного, но не третичного спирта над металлической медью при повышенной температуре происходит выделение двух атомов водорода и первичный спирт превращается в альдегид, вторичные спирты дают в этих условиях кетоны.
|
|
|
|
третичные спирты в тех же условиях не дегидрируются.
Такое же различие проявляют первичные и вторичные спирты при окислении, которое можно проводить "мокрым" путем, например, действием хромовой кислоты, или каталитически, причем катализатором окисления служит также металлическая медь, а окислителем кислород воздуха:
|
|
|
RCH2OH + O ® R-COH + H2O
 |  |
CHOH + O ® C=O + H2O
Замещение гидроксильной группы спирта водородом.
Спирты устойчивы к действию химических восстановителей. Они не восстанавливаются и водородом над катализатороми. Поэтому спирты применяют в качестве растворителей или доноров при восстановлении других соединений.
Метод непрямого восстановления спиртов действием йодистоводородной кислоты:

Окисление.
Окисление первичных спиртов в альдегиды и вторичных спиртов в кетоны является одним из важнейших превращений функциональных групп и оценкой избирательного действия реагента, используемого в качестве окислителя.

Третичные спирты не окисляются, а в жестких условиях окисление сопровождается деструкцией углеродного скелета. Наиболее широкое применение для окисления спиртов нашли реагенты на основе переходных металлов - хрома (VI), марганца (VII), марганца (IV).
1.2.7 Образование сложных эфиров спиртов.
Механизм реакции этерификации:
1) Присоединение протона, образование гидроксониевого иона:

2) Катион взаимодействует с молекулой спирта по не поделенной электронной паре атома кислорода, образуя оксониевый ион:

3) Происходит перегруппировка оксониевого иона:

4) Оксониевый ион последовательно выделяет молекулу воды и протон, давая сложный эфир:
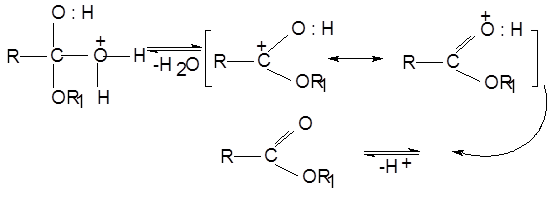
При действии кислородных минеральных и органических кислот на спирты образуются сложные эфиры, например,
 С6Н5ОН+СН3СООН С6Н5СООСН3+Н2О
С6Н5ОН+СН3СООН С6Н5СООСН3+Н2О
 |  |
ROH + SO2 SO2+H2O
Такого рода взаимодействие спирта с кислотами называется реакцией этерификации. Скорость этерификации зависит от силы кислоты и природы спирта: с увеличением силы кислоты она возрастает, первичные спирты реагируют быстрее вторичных, вторичные спирты – быстрее третичных. Этерификация спиртов карбоновыми кислотами ускоряется при добавлении сильных минеральных кислот. реакция обратима, обратная реакция называется гидролизом. Сложные эфиры получаются также при действии на спирты галогенангидридов и ангидридов кислот.
|
|
|
Превращение одного сложного эфира в другой под действием соответствующего спирта в присутствии катализатора (кислоты или основания) называют переэтерефикацией.


Хотя реакция обратимая, равновесие можно смещать, например, отгонять низкокипящий спирт (чаще метанол, этанол).
Обсуждение результатов
Получение этилового эфира 4-бромбензойной кислоты возможно:
1) Ацилированием спиртов с хлорангидридами кислот:

Данная реакция протекает необратимо в отличие от реакции этерификации. Но, для того чтобы провести синтез, необходима дополнительная реакция получения хлорангидрида кислоты. Так как реакция протекает бурно, отвод тепла труден.
2) Ацилирование спиртов ангидридами кислот:

Синтез можно проходит без введения катализатора, но также требуется дополнительная реакция для получения ангидрида 4-бромбензойной кислоты.
3) Реакция Вильямсона:

Этот синтез тоже требует дополнительной реакции для получения калиевой соли кислоты.
4) Реакция переэтерефикации (алкоголиз сложных эфиров):

Применяется в случае спиртов, которые имеют разветвленный углеродный скелет, так как в процессе реакции получается большое число побочных продуктов.
5) Реакция этерефикации:

Реакция 4-бромбензойной кислоты с этиловым спиртом в присутствии кислоты наиболее проста в технологическом использование, хотя и обратима.
Экспериментальная часть
Реактивы:
4-бромбензойная кислота М.м.=202,  ,“пушистое” белое вещество;
,“пушистое” белое вещество;
этиловый спирт(95%) М.м.=46,1,  ,
,  ,
,  ;
;
серная кислота(d=1.84) М.м.=98.08, 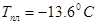 ,
,  ,
, 
Схема прибора:


1- Круглодонная колба на 50 мл.
2- Обратный холодильник
3- Дефлегматор
4- Термометр
5- Нисходящий холодильник
|
|
|
6- Алонж
7- Приемник
8- Делительная воронка
Описание хода синтеза:
В круглодонную колбу на 50 мл. помещаем 4-бромбензойную кислоту 4г., этиловый спирт 25 мл., серную кислоту 1мл. Смесь нагревам на воздушной бане с обратным холодильником. Затем заменяем обратный холодильник на нисходящий и полно отгоняем избыток спирта. Остаток выливаем в 20 мл. холодной воды и нейтрализуем углекислым натрием. Затем отделяем при помощи делительной воронки эфирный слой и сушим его хлористым кальцием.
Выход продукта: m=2.8 г., 70 %
Этиловый эфир 4-бромбензойной кислоты
М.м.=230

 мм.рт.ст.
мм.рт.ст.
РФ эфира 0,8(дихлорэтан)
РФ кислоты 0,05(дихлорэтан)
Выводы:
В ходе проведенной курсовой работы:
1) Собран и обобщен литературный обзор по теме “химические свойства и синтез спиртов”
2) Проведены реакции и наработаны образцы:
по реакции этерификации получен этиловый эфир 4-бромбензойной кислоты
 и выход 70 %
и выход 70 %
Список литературы
1. Глинка Н.Л. Общая химия. – Л.: Химия, 1978. – 720 с.
2. В.Ф. Травень Органическая химия 1,2. – В.: ИКЦ «Академкнига», 2004. –583 с.
3. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – СПб.: «Иван Федоров», 2002. – 624 с.
4. http://www.chemnet.ru/ - «Портал химического образования России.»
5. http://ru.wikipedia.org/- «Портал химии»
|
|
|
12 |


