 |
Тема: Понятие о равновесии фаз
|
|
|
|
Рассмотрим в качестве примера процесс массопередачи, в котором аммиак, представляющий собой распределяемый компонент, поглощается из его смеси с воздухом чистой водой, т.е. в виду отсутствия равновесия переходит из газовой фазы, где его концентрация равна у, в жидкую фазу  , имеющую начальную концентрацию х=0. С началом растворения аммиака в воде начнется переход части его молекул в обратном направлении со скоростью пропорциональной концентрации аммиака в воде и на границе раздела фаз. С течением времени скорость перехода аммиака в воду будет снижаться, а скорость обратного перехода возрастать, причем такой двусторонний переход будет продолжаться до тех пор, пока скорости переноса в обоих направлениях не станут равными друг другу. При равенстве скоростей установится динамическое равновесие, при котором не будет происходить видимого перехода вещества из фазы в фазу, а концентрации аммиака в передающей фазе У и концентрация аммиака в воспринимающей фазе X называются равновесными концентрациями.
, имеющую начальную концентрацию х=0. С началом растворения аммиака в воде начнется переход части его молекул в обратном направлении со скоростью пропорциональной концентрации аммиака в воде и на границе раздела фаз. С течением времени скорость перехода аммиака в воду будет снижаться, а скорость обратного перехода возрастать, причем такой двусторонний переход будет продолжаться до тех пор, пока скорости переноса в обоих направлениях не станут равными друг другу. При равенстве скоростей установится динамическое равновесие, при котором не будет происходить видимого перехода вещества из фазы в фазу, а концентрации аммиака в передающей фазе У и концентрация аммиака в воспринимающей фазе X называются равновесными концентрациями.
Первоначальные неравновесные концентрации фаз (у - концентрация аммиака в воздухе, в передающей фазе; х = 0; концентрация аммиака в воспринимающей фазе) называются рабочими концентрациями.
В самом общем виде связь между концентрациями распределяемого вещества в фазах при равновесии выражается зависимостью:
У = f(X); или X = f(Y)
Эта зависимость изображается линией, которая носит название рабочей линии процесса.

Уравнение массопередачи
При отклонении от состояния равновесия происходит переход вещества из фазы, в которой его содержание выше равновесного, в фазу, где содержание этого вещества ниже равновесного.
Скорость перехода вещества пропорциональна степени отклонения от равновесия, которую можно выразить как разность концентраций - рабочей концентрации вещества в одной из фаз и равновесной концентрацией в ней данного вещества. Эта разность концентраций является движущей силой процесса массопередачи.
|
|
|
Кроме того, скорость перехода вещества пропорциональна поверхности соприкосновения фаз.
Скорость перехода вещества можно определить, как количество вещества, переходящего в единицу времени из одной фазы в другую.
М = К F ΔСt
где:
М - количества вещества, перешедшего из одной фазы в другую, кг/сек; К - коэффициент пропорциональности, называется коэффициентом
массопередачи;
F - поверхность соприкосновения фаз,  ;
;
Δ - движущая сила процесса массопередачи. Движущая сила может быть выражена в любых единицах, применяемых для выражения составов фаз.
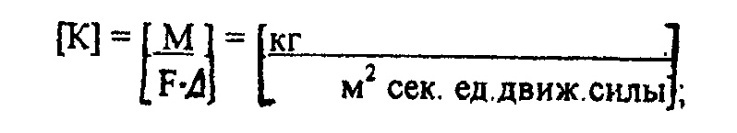
Коэффициент массопередачи выражает количество вещества, переходящего из одной фазы в другую за единицу времени через единицу поверхности соприкосновения при движущей силе, равной 1.
Если движущая сила выражается в виде разности объемных концентраций (кг/  ), то
), то
Δ = С*- С
где:
С - фактическая концентрация компонента в одной из фаз;
С* - равновесная концентрация компонента в той же фазе.
Тогда уравнение примет вид:
М =  Р (С* - С);
Р (С* - С);
Массообмен с участием твердой фазы
В твердой фазе конвекция отсутствует и перенос вещества характеризуется уравнением массопроводности, аналогичным уравнению молекулярной диффузии:
М = 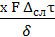
где: х - коэффициент пропорциональности, имеющий размерность коэффициента диффузии и называется коэффициентом массопроводности;
 - изменение концентрации по толщине слоя, кг/м3;
- изменение концентрации по толщине слоя, кг/м3;
τ - время;
δ - толщина слоя, м;
F - поверхность соприкосновения.
Если распределяемое вещество переносится из твердой фазы в омывающую ее жидкую, газовую или паровую фазу, то в пределах твердой фазы вещество перемещается вследствие массопроводности к границе раздела фаз и далее переносится в омывающую фазу путем конвективной диффузии.
|
|
|
Перемещение вещества вследствие массопроводности является неустановившимся процессам, в начальный момент концентрация вещества ( ) одинакова во всем объеме твердого тела. В момент времени τ средняя концентрация (У) ниже начальной, причем распределение концентрации в твердом теле неравномерно - в центре концентрация больше, а у границы раздела фаз меньше. При τ = оо концентрация выравнивается и стремится к равновесию (У*).
) одинакова во всем объеме твердого тела. В момент времени τ средняя концентрация (У) ниже начальной, причем распределение концентрации в твердом теле неравномерно - в центре концентрация больше, а у границы раздела фаз меньше. При τ = оо концентрация выравнивается и стремится к равновесию (У*).
Лекция №13
Тема: Абсорбция
Абсорбцией называется процесс поглощения газов или паров из газовых или парогазовых смесей жидкими поглотителями (абсорбентами).
При физической абсорбции, поглощаемый газ (абсорбтив), не взаимодействует химически с абсорбентом. Если же абсорбтив образует с абсорбентом химическое соединение, то процесс называется хемосорбцией.
Физическая абсорбция в большинстве случаев обратима. На этом свойстве абсорбционных процессов основано выделение поглощенного газа из раствора - десорбция.
Сочетание абсорбции с десорбцией позволяет многократно применять поглотитель и выделять поглощенный компонент в чистом виде.
В промышленности процессы абсорбции применяются главным образом для:
1 ) извлечения ценных компонентов из газовых смесей;
2) для очистки этих смесей от вредных примесей.
(Например, поглощение аммиака, бензола из коксового газа, абсорбция хлористого водорода водой и др.)
В качестве абсорбентов могут применяться вода, органические растворители. На химическом комбинате в основном применяются высококипящие углеводороды: пентан, гексан, бензин и др. или сжиженные газы – бутаны, бутилены, пропан, пропилен и др. Метод применяется, когда разница между температурами кипения не менее 10°С. Разделение идет за счет разницы температур кипения, но с помощью холодного абсорбента, который орошает колонну сверху. Абсорбцию проводят при температуре не выше 20°С, т.к. резко падает растворимость газов. Абсорбент увлекает за собой вниз колонны высококипящий компонент. Соотношение абсорбента и углеводорода составляет 5-8:1.
|
|
|
Абсорбенты должны обладать избирательным действием, т.е. хорошо поглощать не всю смесь газов или паров, а лишь определенные компоненты.
и хранят в герметически закупоренной посуде. Процесс проводят при пониженной температуре, т.к. при понижении температуры Абсорбция - процесс диффузионный, поэтому скорость абсорбции определяется скоростью диффузии. Исходя из уравнения массопередачи:
М = К F Δ  τ;
τ;
для ускорения процесса и для достижения высокой степени поглощения необходимо увеличивать разность концентраций диффундирующего вещества в газе и в пограничном слое жидкости. Поэтому необходимо обеспечить наибольшую поверхность соприкосновения газа (пара) с жидкостью и постоянную смену пограничных с газом слоев жидкости.
В этих целях в абсорберах различными способами осуществляют увеличение поверхности соприкосновения фаз и взаимодействующие вещества проходят через аппарат непрерывно противотоком друг другу
Поскольку в процессе абсорбции происходит растворение газов в жидкости, на ход процесса оказывает также значительное влияние давление газа и температура абсорбента.
Пример: приготовление газированной воды, которую насыщают двуокисью углерода при повышенном давлении (более 4 кГс/  ) растворимость газов повышается-.
) растворимость газов повышается-.
При нагревании использованного абсорбента, поглощенный им газ, выделяется из жидкости, т.е. происходит процесс десорбции. На практике десорбцию осуществляют как с повышением температуры абсорбента, так и понижением давления, при этом не только происходит выделение поглощенных газов, но и восстанавливается поглотительная способность абсорбента.
Удельный расход поглотителя
Удельный расход поглотителя, т.е. количество поглотителя, необходимое для поглощения какого-либо компонента из 1 кг газовой смеси, находится в зависимости от величины поверхности соприкосновения фаз, т.е. в конечном счете от размеров абсорбера. Чем меньше размер абсорбера, тем больше потребуется поглотителя для обеспечения необходимой степени извлечения поглощаемого компонента.
|
|
|
Материальный баланс
Материальный баланс характеризуется уравнением:
М = G( ) = L(Х2-Х1)
) = L(Х2-Х1)
где: G – количество газа,
L – количество поглотителя,
Y1 – начальная концентрация компонента в газовой фазе,
Y2 – конечная концентрация компонента в газовой фазе,
Х1 – начальная концентрация компонента в жидкой фазе,
Х2 – конечная концентрация компонента в жидкой фазе,
L = G 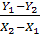
называется удельным расходом поглотителя.
Отношение количества фактически поглощенного компонента ( ) к количеству, поглощенному при полном извлечении называется степенью извлечения. ε =
) к количеству, поглощенному при полном извлечении называется степенью извлечения. ε = 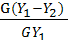
Лекция № 14
|
|
|


