 |
III. Оценочные материалы для проведения аттестации по учебной дисциплине
|
|
|
|
Матрица
| Номер вопроса | Код результата | Номер задания | Код результата |
| З 1 | У3 | ||
| З 2 | У2 | ||
| З 2 | У2 | ||
| З 3 | У8 | ||
| З 3 | У8 | ||
| З 3 | У3 | ||
| З 3 | У4 | ||
| З 3 | У8 | ||
| З 1 | У8 | ||
| З 3 | У8 | ||
| З 3 | У8 | ||
| З 3 | У2 | ||
| З 3 | У8 | ||
| З 3 | У8 | ||
| З 3 | У2 | ||
| У7 | У2 | ||
| У4 | У2 | ||
| У7 | У2 | ||
| У3 | У2 | ||
| У3 | У3 | ||
| У7 | У8 | ||
| У7 | У8 | ||
| У7 | У8 | ||
| У7 | У8 | ||
| У7 | У8 | ||
| У7 | У8 | ||
| У7 | У1 | ||
| З1 | У8 | ||
| З4 | У1 | ||
| З4 | У8 |
Вопросы
1. Основные понятия химии. Вещество, материя, атом, химический элемент, моль. Атомная, молекулярная и молярная массы. Атомная единица массы. Абсолютная и относительная атомные и молекулярные массы.
2. Качественный и количественный состав вещества. Молярный объем. Число Авогадро.
3. Стехиометрия. Важнейшие стехиометрические законы. Закон сохранения массы вещества, закон постоянства состава, закон простых объёмных отношений, закон Авогадро и следствия из этого закона. Относительная плотность газов.
4. Ядерная модель атома. Атомные спектры. Энергетическое состояние электрона в атоме. Понятие о квантовых числах. Главное, орбитальное, магнитное и спиновое квантовые числа.
5. Строение электронных оболочек атомов. Электронная структура атомов и периодическая система Д.И. Менделеева. Формулировка периодического закона Д.И. Менделеева.
6. Химическая связь. Виды химической связи: ковалентная, ионная и металлическая. Полярная и неполярная ковалентная связь. Два механизма образования ковалентной связи (обычный и донорно-акцепторный). Понятие о дипольном моменте молекул.
|
|
|
7. Энергия ионизации, энергия сродства к электрону. Электроотрицательность. Относительная электроотрицательность. Характер изменения ее величины в рядах и периодах периодической системы Д.М. Менделеева. Степень окисления.
8. Химическая кинетика. Скорость химических реакций. Зависимость скорости реакций от концентрации реагирующих веществ и давления. Закон действующих масс. Константа скорости химической реакции.
9. Химическая кинетика. Скорость химических реакций. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Энергия активации. Энергетические диаграммы экзо- и эндотермических процессов.
10. Химическая кинетика. Факторы, влияющие на скорость химических реакций. Катализаторы. Зависимость скорости химических реакций от катализатора. Положительный и отрицательный катализ. Энергетическая диаграмма каталитического процесса. Какое влияние оказывает катализатор на состояние химического равновесия?
11. Химическое равновесие. Константа химического равновесия. Влияние концентрации, температуры и давления на состояние равновесия. Принцип Ле-Шателье.
12. Растворы. Классификация растворов по степени дисперсности. Место растворов среди других дисперсных систем. Растворимость твердых веществ в воде. Коэффициент растворимости. Насыщенные, ненасыщенные и пересыщенные растворы. Тепловые эффекты при растворении.
13. Растворы. Способы количественного выражения состава растворов. Массовая, объемная и мольная доли.
14. Электролитическая диссоциация. Диссоциация слабых электролитов как равновесный процесс. Степень диссоциации и константа диссоциации. Факторы, влияющие на процесс диссоциации.
15. Растворы электролитов. Диссоциация средних, кислых и основных солей. Диссоциация кислот и оснований. Ступенчатая диссоциация.
16. Реакции ионного обмена в растворах электролитов. Условия практической необратимости протекания реакций ионного обмена..
|
|
|
17. Гидролиз. Гидролиз солей. Количественные характеристики процесса гидролиза. Степень гидролиза и константа гидролиза. Смещение равновесия процесса гидролиза. Необратимый гидролиз.
18. Окислительно-восстановительные реакции. Степень окисления элемента. Окислитель и восстановитель. Процессы окисления и восстановления. Приведите примеры типичных окислителей и восстановителей. Окислительные процессы в сварочной ванне.
20. Характер взаимодействия металлов с водой, растворами солей, щелочей и кислот. Особенности взаимодействия металлов с концентрированной серной кислотой и азотной кислотой. Как реагирует железо с сильно разбавленной, разбавленной и концентрированной азотной кислотой? Составьте уравнения соответствующих реакций.
21. Сплавы. Сталь. Чугун
22. Коррозия металлов. Классификация коррозионных процессов. Химическая и электрохимическая коррозия. Приведите примеры. Микро - и макрогальванические элементы. Причины электрохимической гетерогенности поверхности металла
23. Способы защиты металлов от коррозии. Металлические катодные и анодные покрытия. Рассмотрите на каком-либо примере механизм защитного действие анодного металлического покрытия в кислой среде.
24. Способы защиты металлов от коррозии. Металлические катодные и анодные покрытия. Как протекает коррозия металла с катодным металлическим покрытием при нарушении его целостности в водной среде в присутствии кислорода?
25. Способы защиты металлов от коррозии. Неметаллические защитные покрытия. Виды неметаллических защитных покрытий и их применение.
26. Способы защиты металлов от коррозии. Химическая обработка среды. Регулирование pH, удаление кислорода.
27. Способы защиты металлов от коррозии. Электрохимическая защита. Протекторная защита и катодная защита.
28. Особенности органических соединений. Теория химического строения. Изомерия и гомология. Классификация и номенклатура органических соединений.
29. Углеводороды: алканы, циклоалканы, алкены, алкины, алкадиены, ароматические соединения.
30. Производные углеводородов: галогенпроизводные, спирты, альдегиды и кетоны, фенолы, простые эфиры, карбоновые кислоты, сложные эфиры, нитросоединения, амины.
|
|
|
31. Мономеры, олигомеры и полимеры. Методы получения полимеров. Реакции полимеризации и поликонденсации. Строение и свойства полимеров.
3. Задания:
1. Напишите электронные и электронно-графические формулы атомов с порядковыми номерами 14,22,29.
2. Укажите типы связей в молекулах: CI2, HCI, KBr, KHSO4
3. Определите степень окисления всех атомов в молекулах: V2O; Na2B4O7; KClO4; NH3; K2HPO4; Na2Cr2O7
4. Во сколько раз увеличиться скорость реакции: N2+3H2-> 2NH3 при увеличении давления в 2 раза?
5. Как изменится скорость реакции, имеющей температурный коэффициент g=3, при повышении температуры с 20 до 60 0С?
6. Какой инертный газ и ионы каких элементов имеют одинаковую электронную конфигурацию с частицей, возникающей в результате удаления из атома кальция всех валентных электронов?
7. Напишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза следующих солей: CuCl2, K3PO4, Na2SО4, Al2S3. Укажите реакцию среды в водных растворах этих солей.
8. Вычислить массу метана количеством вещества 0,1 моль.
9. Вычислить объем диоксида углерода при н.у., взятого количеством вещества 3 моль.
10. Сколько молекул содержится в 11,2 л (н.у.) СО2.
11. Вычислите массу нитрата натрия, который можно получить из 50 г гидроксида натрия и 200 г азотной кислоты
12. Каков состав ядер изотопов 12C и 13C, 14N и 15N?
13. Вычислить массовую долю хлорида натрия в растворе, если 40 г его растворено в 280 мл воды.
14. Определите массу нитрата натрия и воды, необходимые для приготовления 800 г раствора с ω(NaNO3) = 12%.
15. Составьте ионное уравнение реакции MgCl2 + 2AgNO3 = 2AgCl + Mg(NO3)2
16. Определите сумму коэффициентов в молекулярном уравнении ОВР:
KMnO4 + HCl = KCl + MnCl2 + Cl2 + H2O
17. Какова относительная молекулярная масса Mr фенола?
18. В следующем уравнении реакции определите окислитель и восстановитель, их степень окисления, расставьте коэффициенты
Zn + KNO3 + KOH → K2ZnO2 + NH3 + H2O
19. Закончите уравнение, учитывая, что концентрированная серная кислота с малоактивными (тяжелыми) металлами восстанавливается до SO2, с активными (легкими)-до H2S:
|
|
|
Ca (акт.) + H2SO4(конц.) →…
20. Составьте генетический ряд металла –калия


 Металл основной оксид основание соль
Металл основной оксид основание соль
21. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
22. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
23. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов
24. Смесь меди и алюминия массой 20 г обработали 96 %-ным раствором азотной кислоты, при этом выделилось 8,96 л газа (н. у.). Определить массовую долю алюминия в смеси..
25. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O2 = 2MqO + 1204 кДж
26. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
27. Напишите структурные формулы: а) 2-метил-3-этилбензола; б) 3-метил-3-этилпентан, в) 2,3 –диметилгексена-3; г) 2- метилпентадиена-1,3; д) 2,25-триметилгексина-3
28. При взаимодействии предельного альдегида массой 5,8г с избытком гидроксида меди (II) при нагревании образовалось 14,4г осадка оксида меди (I). Установите молекулярную формулу альдегида.
29. Напишите структурные формулы следующих одноатомных спиртов: а) 2- этилпропанол-2; б) 3,3-диметилпентанол-2; в) 2,4,4-триметилоктанол-3; г)3,3-диметилбутанол-2 д) 2,2- диэтилгексаналь; е) 2,2- диметилпентаналь; ж) 2- метилпентановой кислоты; з) 2,2- диметилбутановой кислоты.
30. При окислении альдегида массой 8,6 г аммиачным раствором оксида серебра выделилось серебро массой 21,6 г. Вычислите молекулярную массу альдегида.
Эталоны ответов и решений
| Номер задания | Ответ |
| 14Si: 1s22s22p63s23p2 | |
| Cl2- ковалентная -неполярная | |
| V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2 | |
| Ar | |
CuCl2=Cu2++2Cl- H2O 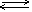 H++OH- Cu2++H2O H++OH- Cu2++H2O 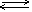 CuOH++H+ Образуется слабодиссоциируемый катион CuOH+. Среда в растворе кислая.
CuCl2+H2O CuOH++H+ Образуется слабодиссоциируемый катион CuOH+. Среда в растворе кислая.
CuCl2+H2O 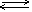 CuOHCl+HCl CuOHCl+HCl
| |
| 1,6 | |
| 67,2 | |
| 9,03∙10²³ | |
| 106,25г (NaNO3) | |
| 12С: 6р + 6n; 13С: 6р + 7n; 14N: 7p + 7n; 15N: 7p + 8n. | |
| 0,125 или 12,5%. | |
| m(NaNO3) = 96 г, m(H2O) = 704 г. | |
| Mg2+ + 2Cl- + 2Ag+ + 2NO3-® 2AgCl¯ + Mg2+ + 2NO3- Ag+ + Cl- ® AgCl¯ | |
| 4Zn + KNO3 + 7KOH = 4K2ZnO2 + NH3 + 2H2O | |
| Са+Н2SO4 =Ca SO4 +Н2S+ Н2O | |
| K ® K2O®KOH®KСl | |
| 70% железа, 30% меди. | |
| 50,91% железа, 49,09% алюминия. | |
| 73,73% меди, 12,44% алюминия, 13,83% железа. | |
| 36% (алюминий не реагирует с концентрированной азотной кислотой); | |
| 1803 кДж | |
| 13 г. | |
| СН3-СН2-(С2Н5)С(СН3)-СН2-СН3 | |
| СН3-(С2Н5)-С-(ОН)-СН3 | |
| С5Н10О |
|
|
|
5. Порядок приведения результатов оценки заданий к итоговому суждению о сформированности образовательных результатов.
Оценка «5» соответствует полному ответу на все три вопроса билета.
Оценку «4» студент получает при обязательном выполнении практической части билета и при раскрытии не в полном объеме теоретических вопросов, но имеющего верные представления и суждения по предложенным вопросам билета.
Оценку «3» получает, если раскрывает неполно все вопросы билета и объясняет основные понятия по предложенным вопросам.
Оценка «2» ставится в том случае, если студент имеет слабые представления по теории предложенного вопроса, и не приступил к выполнению его практической части.
Оценка «1», если студент не имеет минимума знаний, определенного государственными стандартами по данной учебной дисциплине.
|
|
|


