 |
Избирательная деградация мРНК
|
|
|
|
Время полужизни мРНК в клетках является важным фактором регуляции экспрессии генов. Феномен деградации мРНК как регуляторного явления впервые обнаружен у бактерий на заре развития молекулярной генетики. Уже тогда все РНК бактериальной клетки были разделены на два класса: стабильные и нестабильные. К первым до сих пор относятся рибосомные и транспортные РНК, тогда как вторую, наиболее гетерогенную по составу группу образуют матричные РНК. Быстрая деградация мРНК после прекращения ее биосинтеза в результате регуляторных воздействий на транскрибируемые гены позволяет бактериальным клеткам легко адаптироваться к изменяющимся условиям окружающей среды и дает им ощутимые селективные преимущества перед клетками, которые не обладают таким регуляторным механизмом. Быстрая адаптация особенно актуальна для бактерий – одноклеточных организмов с коротким жизненным циклом.
Как было упомянуто, клетки эукариотических организмов способны выводить мРНК из трансляции, не разрушая ее. Это часто достигается регуляцией процессинга предшественников мРНК, образованием рибонуклеопротеидных комплексов – информосом, или специфической модификацией регуляторных последовательностей мРНК (см. ниже). Тем не менее, селективная деградация мРНК является распространенным механизмом регуляции экспрессии генов в клетках высших организмов. В эукариотических клетках время полужизни стабильных мРНК, таких как глобиновая мРНК, составляет ~17 ч, а время функционирования мРНК факторов роста не превышает 30 мин. Физиологические последствия таких различий очевидны. Если глобиновые мРНК продолжают транслироваться на протяжении всей жизни предшественников эритроцитов, то потребность в факторах роста ограничивается фазами клеточного цикла, непосредственно связанными с делением клеток. В частности, известно, что увеличение стабильности мРНК протоонкогена c-fos под действием мутаций сопровождается непрерывным делением мутантных клеток и образованием опухолей.
|
|
|
Время жизни эукариотических мРНК в цитоплазме чаще всего контролируется их 3’-концевыми нетранслируемыми последовательностями (UTR). Лабильные мРНК содержат в этой области одну или несколько AU-богатых последовательностей длиной около 50 нуклеотидов, называемых ARE-элементами (adenylate/uridylate-rich elements), которые придают полирибонуклеотиду конформации, делающие его высокочувствительным к расщеплению нуклеазами. Искусственное введение таких последовательностей в 3’-концевые области стабильных мРНК приводит к их дестабилизации, что сопровождается резким уменьшением внутриклеточного времени полужизни гибридных мРНК. ARE-элементы были впервые обнаружены у генов цитокинов, участвующих в воспалительных реакциях организма, и в настоящее время описаны для мРНК генов c-fos, c-myc, nur77, junB, b-интерферона, интерлейкина 3, гранулоцит-макрофагового колонийстимулирующего фактора (GM-CSF) и ряда других мРНК. Длина ARE-элементов варьирует от 50 до 150 нуклеотидов, они содержат несколько копий пентануклеотида AUUUA и много остатков U, перемежающихся остатками A.
Различают, по крайней мере, три класса ARE-элементов. Элементы 1-го класса (характерные, в частности для мРНК гена c-fos) содержат одну–три копии последовательности AUUUA, ассоциированные с U-богатой областью или гомополимером U. Для элементов 2-го класса (тип GM-CSF) характерно наличие двух копий перекрывающихся нонануклеотидных последовательностей UUAUUUA(U/A)(U/A), включенных в U-богатую последовательность. Наконец, элементы, принадлежащие к 3-му классу (тип c-jun), совсем не содержат последовательности AUUUA.
|
|
|
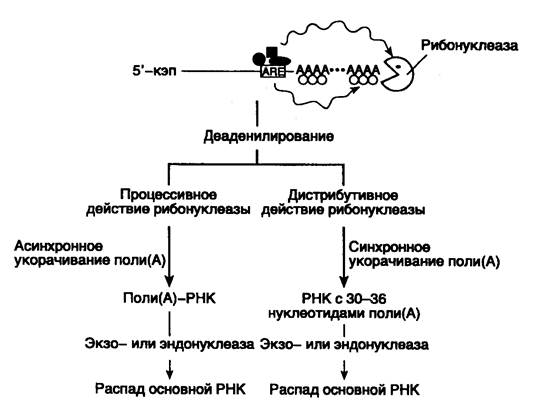
Рис. I.39. Этапы ARE-зависимой деградации мРНК эукариот
Закрашенные геометрические фигуры – белки и факторы, специфически взаимодействующие с ARE-последовательностью. Их возможное влияние на деаденилирование показано волнистыми стрелками. Толщина стрелок указывает на интенсивность реакции
В соответствии с современной моделью ARE-зависимая деградация мРНК происходит двумя различными путями (рис. I.39). Как уже упоминалось выше, этот процесс начинается с деаденилирования 3’-концевых поли(A)-последовательностей мРНК. Процесс деаденилирования проходит с разной скоростью в зависимости от класса ARE-последовательностей, присутствующих в мРНК. При наличии ARE-элементов 2-го класса (тип GM-CSF) деаденилирование отдельных молекул протекает асинхронно по процессивному механизму и заканчивается образованием молекул мРНК, не содержащих 3’-концевых поли(А)-последовательностей (поли(А)--РНК). В отличие от этого ARE-элементы 1-го и 3-го классов направляют деаденилирование по дистрибутивному механизму. При этом отдельные молекулы деаденилируются синхронно, и на концах мРНК остаются поли(А)-последовательности длиной в 30–60 нуклеотидов. Скорость дальнейшей деградации процессированных мРНК может быть различной и зависит от регулируемой на уровне деградации мРНК экспрессии генов.
Таким образом, наличие в структуре мРНК различных классов специфических ARE-последовательностей, а также множественных белков-регуляторов, взаимодействующих с этими последовательностями, контролирует кинетику деградации мРНК в клетках. Аналогичные механизмы имеют место, в частности в селективной защите или дестабилизации мРНК в ответ на изменение внутриклеточных условий, например при гормональных воздействиях.
Изменение длины поли(А)-последовательностей мРНК. Выше было отмечено, что кэпирование и полиаденилирование процессированных эукариотических мРНК повышают эффективность их трансляции рибосомами. В некоторых случаях эффективность трансляции мРНК, содержащих 3’-концевые поли(A)-последовательности, регулируется путем специфического изменения длины таких гомополимеров. В частности, у слизневиков Dictyostelium этот механизм играет ключевую роль в жизненном цикле. При переходе слизневиков от стадии вегетативного роста (амеба) к образованию плодового тела в клетках синтезируется новый набор мРНК. Одновременно резко укорачивается длина поли(A)-последовательностей мРНК, синтезированных и используемых в вегетативной стадии развития организма. В результате происходит переключение трансляции с мРНК, запасенных в вегетативной фазе роста, на вновь синтезированные мРНК. Аналогичные эффекты наблюдаются в слюнных железах личинок дрозофилы, в процессе развития двустворчатого моллюска Spisula, а также в ооцитах шпорцевой лягушки Xenopus.
|
|
|
Хорошо изученным примером регуляции экспрессии генов на уровне полиаденилирования соответствующих мРНК является также дифференциальное полиаденилирование мРНК белка U1A – компонента U1-мяРНП. Установлено, что 3’-концевые нетранслируемые участки (3’-UTRs) U1A-мРНК различных организмов содержат две копии консервативных последовательностей, которые обладают способностью связывать U1A-белок. В результате синтез избытка U1A-белка ингибирует полиаденилирование мРНК in vivo. При этом происходит подавление полимеризации AMP как следствие прямых контактов белка с поли(А)-полимеразой. После такой дестабилизации U1A-мРНК наблюдается пропорциональное снижение внутриклеточного уровня U1A-белка, т.е. имеет место регулирование его биосинтеза по принципу обратной связи.
Изменения кэп-группы мРНК. Своеобразный механизм контроля трансляции мРНК используется в онтогенезе некоторых бабочек. Например, у табачного бражника Manduca sexta эффективность трансляции определенных мРНК изменяется при ковалентной модификации их 5’-концевых кэп-групп. В ооцитах бражника запасенные мРНК содержат кэп-группу в виде неметилированного остатка гуанозина. Такие мРНК не транслируются рибосомами в бесклеточной белоксинтезирующей системе. Однако после оплодотворения кэп-группы мРНК быстро метилируются с образованием остатка 7-метилгуанозина и становятся активными матрицами при трансляции.
Этим примером мы завершим рассмотрение механизмов регуляции экспрессии генов путем посттранскрипционных модификаций мРНК и их предшественников. Как видно из изложенного материала, все регуляторные модификации структуры РНК оказывают влияние на экспрессию генов, транскриптами которых они являются, через изменение эффективности трансляции этих мРНК рибосомами. Фактически все вышеперечисленные механизмы регуляции экспрессии генов направлены на изменение матричной активности РНК-посредников (мРНК), с помощью которых происходит перенос генетической информации от транскрибируемых генов к белкам. Такие механизмы оказывают регуляторное действие на уровень экспрессии регулируемых генов через изменение эффективности функционирования аппарата трансляции клеток организма. Тем не менее, среди механизмов, регулирующих экспрессию генов на уровне трансляции, многие непосредственно направлены на изменение функциональной активности самих компонентов аппарата трансляции: рибосом и многочисленных факторов трансляции, принимающих прямое участие в биосинтезе белков. Некоторые из этих механизмов будут рассмотрены в следующем разделе.
|
|
|
|
|
|


