 |
Теория молекулярных орбиталей (ТМО)
|
|
|
|
ТЕМА № 3. ХИМИЧЕСКАЯ СВЯЗЬ
Общие представления о химической связи. Причины образования химической связи
Химическая связь – совокупность сил, удерживающих атомы или ионы в молекулах и кристаллах. Существует два основных типа приближений в описании химической связи: теория валентных связей (ТВС) и теория молекулярных орбиталей (ТМО). При подходе с позиций ТВС химическая связь рассматривается как результат образования общей электронной пары (или нескольких электронных общих пар), принадлежащих двум связываемым ей атомам. Здесь принимается во внимание только те валентные электроны, которые участвуют в образовании общей электронной пары. При использовании ТМО исходят из того, что в образовавшейся молекуле все электроны исходных атомов располагаются по новым, молекулярным орбиталям, совместно участвуя в образовании связи, т.е. все электроны принадлежат единой системе – молекуле.
При рассмотрении взаимодействия между двумя атомами можно выделить два крайних случая:
· соединение одинаковых атомов или атомов с близкими значениями ЭО;
· соединение атомов, резко отличающихся значениями ЭО. Эти случаи соответствуют двум типам химической связи: ковалентной и ионной.
Знакомство с природой химической связи мы начнем с рассмотрения простейшей частицы – молекулярного иона водорода Н+2. Он состоит из двух ядер водорода – протонов Н+ и одного электрона; хотя в обычных условиях такие частицы отсутствуют, так как очень легко и быстро реагируют с электроном или даже отрывают электрон от других частиц. В молекулярном ионе Н+2 действуют силы притяжения и отталкивания (рис. 3.1).

а
б в
Рис.1. Образование молекулярного иона водорода Н+2.
|
|
|
На каждое положительно заряженное ядро Н+ со стороны другого ядра действует сила отталкивания (рис. 3.1 а), а со стороны отрицательно заряженного электрона – сила притяжения (рис. 3.1. б, в). Силы межъядерного отталкивания f (Н+АH+B) стремятся развести ядра (а). Молекула образуется в том случае, если взаимное отталкивание ядер Н+А и Н+В компенсируется притяжением электрона к ядрам. Возможность этого состояния зависит от местоположения электрона относительно ядер Н+А и Н+В.
Когда электрон находится в положении б, то его притяжение к протонам (силы f (Н+Аē) и f (H+Bē)) способствует их сближению (силы f' (Н+Аē) и f' (H+Bē)), компенсируя силы отталкивания (f (Н+АH+B)). Когда электрон находится в положении в, силы притяжения направлены в одну сторону. В этом случае силы отталкивания протонов не компенсируются силами притяжения.
Обобщая эти рассуждения, можно сказать, что в молекуле имеется область связывания и область разрыхления (антисвязывания) (рис. 3.2). Если электрон находится в области связывания, то молекула образуется, если нет – то ион Н+2 не существует.
 |
Связывание
Разрыхление Разрыхление
Атомные ядра
Рис. 3.2. Области связывания и разрыхления в молекулярном ионе Н+2.
Таким образом, химическая связь возникает в том случае, если электрон находится между ядрами. При осуществлении химической связи между атомами, т.е. при образовании молекулы из атомов полная энергия молекулы – сумма кинетической и потенциальной энергий – понижается, что приводит к выделению энергии. Чем больше выделяется энергии, тем прочнее химическая связь.
Энергия, которая выделяется при образовании химической связи между двумя атомами, называется энергией связи.
Длина связи – расстояние между ядрами атомов, образовавших химическую связь.
Теория молекулярных орбиталей (ТМО)
Описать молекулы согласно ТМО – это значит определить тип ее орбиталей, их энергию и выяснить характер распределения электронов по орбиталям, т.е. решить те же задачи, что и при рассмотрении электронных структур атомов.
|
|
|
ТМО позволяет оценить прочность химической связи (энергию и длину(), порядок связи, энергию ионизации молекулы, объяснить магнитные свойства молекул и окраску веществ.
В основе ТМО лежат уже знакомые нам положения и приближения:
1. В молекуле все электроны находятся в поле всех ядер, но реально можно рассматривать делокализацию только валентных электронов.
2. При описании состояния электронов в молекуле можно использовать одноэлектронное приближение, т.е. рассматривать волновые функции электронов в поле нескольких (чаще всего двух) центров, имеющих определенные эффективные заряды. Такие волновые функции называются МО.
Молекулярная орбиталь – пространство в молекуле, в котором вероятно пребывание электрона.
3. МО можно рассматривать как результат интерференции волновых функций электронов сближающихся атомов, и в этом смысле можно говорить о расщеплении атомных орбиталей в поле нескольких центров. МО подобно АО могут быть изображены в виде электронных облаков определенной формы. Число МО должно быть равно числу АО, взятых для их построения.
МО есть результат комбинации АО, которая сводится к их перекрыванию. При образовании МО возможно положительное и отрицательное перекрывание электронных облаков (рис. 3.3). При положительном перекрывании образуется связывающая МО, при отрицательном – разрыхляющая МО. Связывающая МО характеризуется повышенной электронной плотностью в пространстве между ядрами, поэтому такая орбиталь энергетически наиболее выгодная, чем АО.
АО МО
Отрицательное
 Перекрывание АО
Перекрывание АО
z (s*s)
1s 1s z (ss)
Положительное
Рис. 3.3. Схема образования МО.
Сказанное можно изобразить в виде энергетической диаграммы.
АО МО АО
 Е s*s
Е s*s
1s 1s
ss
Диаграмма 1
Энергетическую диаграмму 1 используют для описания молекулярных образований Н+2, Н2, Не2+, Не2. Обобществленные электроны распределяют по молекулярным орбиталям согласно принципам наименьшей энергии и Паули. По характеру распределения электронов по орбиталям оценивают порядок связи.
|
|
|
ПС = (число связывающих электронов – число разрыхляющих электронов)
Реакцию образования молекулы водорода из атомов можно записать:
Н [1s1] + H [1s1] = Н2 [ss2], ПС = (2-0) / 2 = 1, молекула диамагнитна.
 Е АО (Н) МО (Н2) АО (Н)
Е АО (Н) МО (Н2) АО (Н)
s*s
1s 1s
ss
Не[1s2] + Hе[1s2] = Не2[ss2s*s2], ПС = (2-2) /2 = 0, молекула диамагнитна.
 Е АО (Не) МО (Не2) АО (Не)
Е АО (Не) МО (Не2) АО (Не)
s*s
1s 1s
ss
Диаграмму 2 используют для описания двухатомных гомоядерных молекул элементов 2-го периода, расположенных в конце периода периодической системы (О2 или фтор).
Последовательность заполнения орбиталей выглядит следующим образом:
sS < sS* < sZ < pX = pY < p*X = p*Y < s*Z
О [2s22р4] + О [2s22р4] = О2 [ss2s*s2sZ2p2Xp2Yp*1Xp*1Y], ПС = (8-4) / 2 = 2. Молекула парамагнитна.
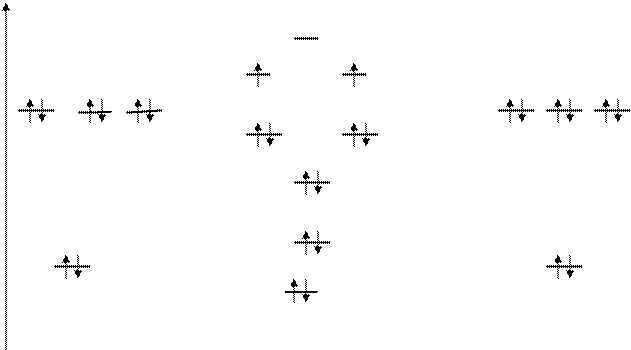 Е АО (О) МО (О2) АО (О)
Е АО (О) МО (О2) АО (О)
s*Z
p*X p*Y
2р pX pY 2р
sZ
sS*
2s 2s
sS
Диаграмма 2
Диаграмму 3 используют для описания двухатомных гомоядерных молекул элементов 2-го периода, расположенных в начале периода периодической системы (бор, углерод, азот). Эта же диаграмма используется для описания гетероядерных молекул. Последовательность заполнения орбиталей выглядит следующим образом:
sS < sS* < pX = pY <sZ < p*X = p*Y < s*Z
С [2s22р2] + С [2s22р2] = С2 [ss2s*s2 p2Xp2Y], ПС = (6-2) / 2 = 2.
Молекула диамагнитна.
Последовательность заполнения орбиталей гетероядерной молекулы СО выглядит так:
sS < sS* < pX = pY <sZ < p*X = p*Y < s*Z
С [2s22р2] + О [2s22р4] = СО [ss2s*s2 p2Xp2Ys2Z], ПС = (8-2) / 2 =3.
Молекула диамагнитна.
Парамагнитными веществами являются вещества, у которых имеются неспаренные электроны на диаграмме МО.
Диамагнитными являются вещества, у которых нет неспаренных электронов.
 Е АО (С) МО (С2) АО (С)
Е АО (С) МО (С2) АО (С)
s*Z
p*X p*Y
sZ
2р pX pY 2р
sS*
2s 2s
sS
 Е АО(С) МО(СО) АО(О)
Е АО(С) МО(СО) АО(О)
s*Z
p*X p*Y
sZ
2р pX pY 2р
sS*
2s 2s
sS
Энергия ионизации молекул зависит от характера распределения электронов по связывающим и разрыхляющим орбиталям. В двухатомной молекуле связывающие электроны заселяют орбитали энергетически более выгодные, чем атомные орбитали, поэтому они связаны с ядрами молекулы прочнее, чем в атоме. Разрыхляющие электроны, наоборот, располагаются на энергетически менее выгодных молекулярных орбиталях, чем атомные орбитали, и они слабее связаны с ядрами молекулы, чем с ядрами свободного атома.
|
|
|
|
|
|


