 |
Типовые задачи и их решение. 2NO(г) + О2(г) = 2 NO2(г), если
|
|
|
|
Типовые задачи и их решение
1. В системе: СО(г) + Сl2(г) = COCl2(г) концентрацию СО увеличили от 0, 3 до 1, 2 моль/л, а концентрацию хлора – от 0, 2 до 0, 6 моль/л. Определить, во сколько раз возрастет скорость реакции?
Решение. На основании закона действия масс скорость гомогенной реакции (V) выражается через концентрации реагирующих веществ следующим образом:
V = k ∙ с (СО) ∙ с (Cl2),
где с (СО) – молярная концентрация оксида углерода (II), моль/л;
с (Cl2) – молярная концентрация хлора, моль/л;
k – коэффициент пропорциональности (константа скорости).
Начальная скорость: Vo = k ∙ 0, 3 ∙ 0, 2 = 0, 06 ∙ k.
С увеличением концентраций реагирующих веществ она (V1) возрастет и составит:
V1 = k ∙ 1, 2 ∙ 0, 6 = 0, 72 ∙ k.
Тогда: 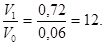
Следовательно, скорость реакции возрастет в 12 раз.
2. Определить, как изменится скорость реакции:
2NO(г) + О2(г) = 2 NO2(г), если
а) увеличить давление в системе в 3 раза;
б) повысить концентрацию NO в 3 раза?
Решение. На основании закона действия масс скорость реакции:
а) до изменения давления выражается уравнением:
Vo = k ∙ с2 (NO) ∙ с (O2).
Вследствие увеличения давления в 3 раза концентрация каждого из реагирующих веществ возросла в 3 раза. Скорость изменилась и составила:
V1 = k ∙ (3 с)2 (NO) ∙ 3 с (O2) = 27 ∙ k ∙ с2 (NO) ∙ с (O2).
Следовательно, скорость реакции возросла в 27 раз:
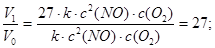
б) с повышением концентрации NO в 3 раза скорость составит:
V1 = k ∙ (3 с)2(NO) ∙ с (O2) = 9 ∙ k ∙ с2(NO) ∙ с (O2).
Сравнив выражения для Vо и V1, находим, что скорость реакции возрастает в 9 раз:
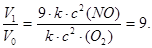
3 Определить, во сколько раз увеличится скорость химической реакции, если повысить ее температуру на 30 оС. Температурный коэффициент скорости реакции (γ ) равен 3.
|
|
|
Решение. Согласно правилу Вант-Гоффа:

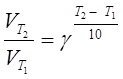
 ,
,
где Т2 – Т1 = Δ Т; Δ Т = 30. Подставим значения:

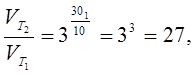
т. е. скорость реакции увеличиться в 27 раз.
4. Определить, чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 50 оС скорость реакции возрастает в 32 раза?
Решение. Согласно уравнению Вант-Гоффа:

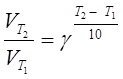 .
.
Подставим значения: 
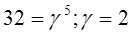 .
.
5. При 130 оС некоторая реакция заканчивается за 24 минуты. Принимая температурный коэффициент скорости реакции равным 2, рассчитать за какое время закончится эта реакция если проводить ее:
а) при 150 оС; б) при 80 оС.
Решение. Между скоростью реакции и временем ее протекания существует обратно пропорциональная зависимость:
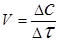 .
.
Следовательно, правило Вант-Гоффа можно записать:

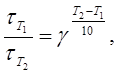
где 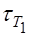 – время реакции при температуре Т1 ;
– время реакции при температуре Т1 ;
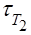 – время реакции при температуре Т2.
– время реакции при температуре Т2.
а) Т1 = 273 + 130 = 403 К; Т2 = 273 + 150 = 423 К; 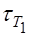 = 24 мин;
= 24 мин; 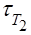 = х;
= х;
γ = 2. Подставим значения:
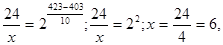
х = 6 мин,
т. е. при температуре 150 оС реакция закончится за 6 минут.
б) Т1 = 403 К; Т2 = 353 К; 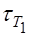 = 24 мин;
= 24 мин; 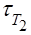 = х; γ = 2.
= х; γ = 2.
Подставим значения:
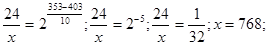
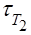 = 768 мин = 12 час 48 мин, т. е. при температуре 80 оС реакция закончится за 12 час 48 мин.
= 768 мин = 12 час 48 мин, т. е. при температуре 80 оС реакция закончится за 12 час 48 мин.
6. При нагревании оксида азота (IV) в закрытом сосуде до некоторой температуры равновесие реакции: 2NO2(г) ↔ 2NO(г) + O2(г) устанавливается при концентрации веществ (моль/л): [NO2] = 0, 3; [NO] = 1, 2; [O2] = 0, 6. Вычислить константу равновесия реакции для этой температуры и исходную концентрацию NO2.
Решение. Константу равновесия данной реакции рассчитывают, исходя из равновесных концентраций исходных и конечных веществ в соответсвии с законом действия масс:
[NO]2 ∙ [O2] 1, 22 ∙ 0, 6
[NO2]2 0, 32
|
|
|
Поскольку к моменту установления равновесия в указанной системе образуется 1, 2 моль/л NO, а по стехиометрии реакции из 2 моль NO2 образуется 2 моль NO, то количество израсходованного к этому времени оксида азота (IV) также составит 1, 2 моль/л, что видно из следующей пропорции:
2 моль NO2 – 2 моль NO
Х моль NO2 – 1, 2 моль NO
Х = 1, 2 моль/л,
т. е. израсходованная концентрация с (NO2)изр. = 1, 2 моль/л.
Исходная концентрация NO2 составит: с (NO2)исх. = [NO2] + с (NO2)изр. = 0, 3 + 1, 2 = 1, 5 моль/л.
7. Определить, в сторону прямой или обратной реакции сместится равновесие в следующих системах:
1) 2Н2(г) + О2(г) ↔ 2Н2О(г); DНо (298) = − 483, 6 кДж
2) СаСО3(к) ↔ СаО(к) + СО2(г) ; DНо (298) = 179 кДж
при: а) понижении температуры; б) повышении давления.
Решение. а). Согласно принципу Ле Шателье: понижение температуры приводит к смещению химического равновесия в сторону экзотермического процесса. Поскольку первая реакция – экзотермическая (∆ Но < 0), то с понижением температуры произойдет сдвиг равновесия в сторону прямой реакции. Во второй – эндотермической реакции (∆ Но > 0), наоборот – в сторону обратной.
б). С повышением давления по принципу Ле Шателье должно произойти смещение равновесия в сторону образования меньшего количества молей газообразных веществ (уменьшение объема газа). В первой – гомогенной системе – смещение равновесия произойдет в сторону прямой реакции (3 объема газа → 2 объема газа), а во второй – гетерогенной – в сторону обратной реакции (0 объемов газа → 1 объем газа).
8. В равновесной системе: N2(г) + 3Н2(г) ↔ 2NH3(г) давление увеличили в 5 раз. Рассчитать, как изменятся скорости прямой и обратной реакций? В сторону какой реакции сместится равновесие?
Решение. До изменения давления в равновесной гомогенной системе скорость прямой реакции в соответствии с законом действия масс выражается уравнением:
Vо = k1 ∙ [N2] ∙ [H2]3; Vо = k2 ∙ [NH3]2.
С увеличением давления в 5 раз скорость изменилась и составила:
V1 = k1 ∙ [5N2] ∙ [5H2]3 = 625 ∙ k1 ∙ [N2] ∙ [H2]3;
V1 = k2 ∙ [5NH3]2 = 25 ∙ k2 ∙ [NH3]2.
Сравнивая скорости прямой и обратной реакций, делаем вывод: скорость прямой реакции при повышении давления в гомогенной равновесной системе в 5 раз увеличилась в 25 раз (625/25).
|
|
|
Следовательно, с увеличением давления равновесие в системе сместится в сторону прямой реакции.
9. Процесс образования хлорида аммония обратим: NH3 (г) + HCl (г) ↔ ↔ NH4Cl (к); DНо (298) = − 176, 2 кДж; DGо (298) = − 91, 7 кДж. Выразить и рассчитать константу равновесия (Кс) этой обратимой реакции. Определить, как повлияет: а) увеличение давления; б) уменьшение температуры на смещение равновесия в этой системе?
Решение. Выражение константы обратимой гетерогенной реакции имеет вид:
1
[NH3] ∙ [HCl]
где [NH4Cl] = 1, т. к. кристаллическое вещество.
Уравнение связи константы равновесия и энергии Гиббса:
DGо (298) = − 5, 71 ∙ lg Кс.
Подставляем значения и определяем Кс:
− 91, 7 = − 5, 71 ∙ lg Кс. Получаем: lg Кс ≈ 16. Откуда Кс = 1016.
Большое значение константы равновесия показывает, что при стандартной температуре равновесие реакции сильно смещено вправо.
При увеличении давления равновесие будет смещаться вправо, т. к. прямая реакция протекает с уменьшением давления (2 объема газа → 0 объемов газа). При уменьшении температуры равновесие также будет смещаться вправо, т. к. прямая реакция – экзотермическая (DНо (298) = − 176, 2 кДж).
IV. 1. Зависимость скорости химической
реакции от температуры
|
|
|


