 |
Положение металлов в Периодической системе, особенности строения их атомов, физические свойства.
|
|
|
|
Положение металлов в Периодической системе, особенности строения их атомов, физические свойства.
Большинство химических элементов в Периодической системе относится к металлам, они располагаются по диагонали от бора к астату. К металлам относятся девяноста два химических элемента.
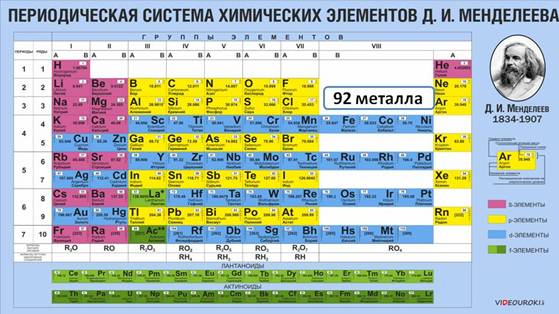
Каждый период (кроме первого) начинается металлом. Так, металлы IA группы называются щелочными металлами. К ним относятся: Li, Na, K, Rb, Cs, Fr. Своё название они получили благодаря соответствующим гидроксидам, которые называются щелочами, т. е. растворимыми в воде основаниями. Щелочные металлы имеют на внешнем энергетическом уровне только один электрон, который они легко отдают, при этом проявляют восстановительные свойства.
Ме0 – ē → Ме+
Причём восстановительные свойства в этой группе увеличиваются от лития к францию, как и радиусы атомов, поэтому растёт и способность к отдаче внешнего электрона. Химическая активность щелочных металлов по группе сверху вниз тоже увеличивается.
Металлы IIA группы также являются типичными металлами и сильными восстановителями, так как в реакциях они отдают два своих электрона. Ме0 – 2ē → Ме2+
Кальций, стронций и барий называют щелочноземельными элементами, потому что их оксиды, которые раньше называли « землями » при растворении в воде образуют щёлочи.
К металлам относятся и элементы IIIA группы кроме бора. У этих металлов на внешнем энергетическом уровне находится три электрона, которые они отдают и превращаются в ионы.
Ме0 – 3ē → Ме3+
В IVA группе к металлам относятся германий, олово, свинец, в VA группе металлами являются сурьма и висмут, в VIA группе – полоний, а в VIIA и VIIIA группе все элементы являются неметаллами.
|
|
|
Элементы побочных подгрупп все являются металлами. Их отличительной особенностью является то, что на внешнем уровне у них обычно содержится один или два электрона, остальные валентные электроны располагаются на предвнешнем слое. К металлам относятся и лантаниды, и актиниды, которые обычно располагаются ниже основной таблицы.
Запомните:
· у металлов сравнительно большие радиусы атомов;
· их внешние электроны значительно удалены от ядра и слабо с ним связаны;
· атомы металлов содержат на внешнем уровне от одного до трех электронов;
· легко отдают электроны, превращаясь при этом в положительные ионы;
· являются восстановителями;
· металлы не могут присоединять электроны.
Однако деление элементов на металлы и неметаллы условно.
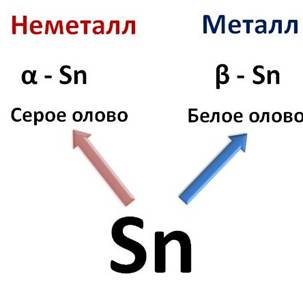
Например, аллотропные модификации олова: так серое, или α -олово – неметалл, а белое, или β -олово – металл.
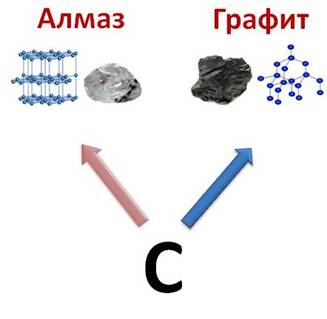
Такая модификация углерода, как алмаз – это неметалл, а графит имеет некоторые характерные свойства металлов.
Такие металлы, как цинк, хром, алюминий и другие – типичные металлы, но образуют оксиды и гидроксиды амфотерного характера. А теллур и йод – типичные неметаллы, но обладают некоторыми свойствами, характерными для металлов.
Физические свойства металлов.
Для металлов характерна металлическая химическая связь. В узлах кристаллической решётки располагаются атомы и положительные ионы металлов, которые связаны благодаря обобществлению внешних электронов, которые принадлежат всему кристаллу.

Для всех металлов характерно твёрдое агрегатное состояние, исключение составляет ртуть – она жидкая.

Для большинства металлов характерен белый или серый цвет, только золото окрашено в желтый цвет, а медь в желто-красный.

|
|
|


