 |
В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
|
|
|
|
В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
Чугун превращают в сталь, удаляя избыточный углерод путём окисления кислородом воздуха в специальных установках – мартеновский печах, конвертерах или электропечах.
Конвертер
Для получения некоторых металлов в качестве восстановителя используют водород. WO3 + 3H2 = W + 3H2O

В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии:
Fe2O3 + 2Al = 2Fe + Al2O3

Восстановление железа методом алюминотермии до сих пор применяется при сварке рельсов.

Этот метод получения металлов был предложен русским учёным Н. Н. Бекетовым.

Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
Электрометаллургия – методы получения металлов, основанные на электролизе, т. е. выделение металлов из растворов или расплавов их соединений с помощью постоянного электрического тока. Этот метод применяют для получения активных металлов – щелочных и щелочноземельных, алюминия, также для получения легированных сталей. С помощью этого метода, английский химик Г. Дэви впервые получил калий, натрий, барий и кальций.

Большое значение имеет микробиологический метод получения металлов. В этом методе используется жизнедеятельность некоторых бактерий. Так, тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. Бактериальный метод применяют для извлечения меди из её сульфидных руд. А затем полученный раствор сульфата меди (II) подаётся на гидрометаллургическую переработку. Кроме этого, учёные обнаружили, что некоторые микроводоросли и бактерии накапливают на своей поверхности отдельные металлы (например, золото) или их оксиды. Микроорганизм постепенно обрастает «шубой» из минеральных частиц, увеличивается в размерах в десятки раз, что позволяет легко выделить частицы из раствора.
|
|
|

При промышленном производстве металлов большое значение имеют вопросы охраны окружающей среды от загрязнений отходами производства. Охрана окружающей среды предусматривает, прежде всего, дезактивацию выбросов, например отходящих газов при выплавке чугуна. Здесь главную опасность представляет образующийся при переработке сернистых руд оксид серы (IV), который, попадая в атмосферу, может вызывать « кислотные дожди ». Наряду с комплексным использованием сырья, строительством очистных сооружений, устройством замкнутых циклов водопользования с целью охраны окружающей среды необходимы вывод промышленных предприятий за городскую черту, создание лесозащитных вокруг городов и промышленных центров.
Таким образом, металлы встречаются в природе в виде соединений или в самородном состоянии. В земной коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов, карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и минералов. Для получения металлов из руд руду сначала измельчают, обогащают, переводят в оксид и только после этого восстанавливают металл. В качестве восстановителей используют C, CO, H2, Si или более активные металлы. Металлургия занимается получением металлов и их сплавов из руд. В зависимости от метода получения металла из руды существует несколько видов металлургических производств: пирометаллургия, гидрометаллургия и электрометаллургия.
|
|
|
Коррозия металлов. Сплавы
Поэт В. Шефнер писал: «Коррозия – рыжая крыса, грызёт металлический лом». А также есть народную мудрость: «Ржа ест железо».
Слово коррозия (от лат. сorrosio –разъедание) – это самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды.

Каждый год из-за коррозии теряется около четверти всего произведённого в мире железа. Порча изделий из металла и потеря металлов обходится очень дорого. Затраты на ремонт или замену изделий во много раз превышают стоимость того металла, из которого они изготовлены.
Коррозия вызывает и серьёзные экологические последствия. Если происходит разрушение трубопроводов газа или нефти, то это приводит к загрязнению окружающей среды, а это негативно сказывается на здоровье людей.




Коррозию металлов и сплавов вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды).

Различают коррозию:
· химическую
· электрохимическую
При химической коррозии металл разрушается под действием окислителей – неэлектролитов, например газов (кислорода, хлора и др. ) при повышенной или даже обычной температурах.
2Fe + 3Cl2 = 2FeCl3
При электрохимической коррозии разрушение металлов происходит в растворах электролитов. Это значит, что в окружающей среде, где находится металл, должны быть вода и окислители: кислород, растворённые кислоты, соли. Так, под действием воздуха и содержащихся в нём паров воды на поверхности медных и бронзовых изделий образуется зелёная плёнка, называемая патиной.
2Cu + O2 + CO2 + H2O = (CuOH)2CO3

Но чаще всего коррозии подвергаются изделия из железа. Особенно сильно коррозирует металл во влажном воздухе и при соприкосновении с водой.
Процесс коррозии железа часто называют ржавлением. Автомобили, сельскохозяйственные машины, стальные балки, кухонная посуда – все эти изделия, будучи новыми, имеют гладкую, блестящую поверхность. Но при хранении во влажной атмосфере и при недостаточном уходе, они покрываются бурыми пятнами ржавчины, состав которой можно выразить обобщённой формулой Fe2O3 · nH2O.
|
|
|



При коррозии металлов и сплавов протекают окислительно-восстановительные реакции, в результате которых атомы металла, взаимодействуя с компонентами окружающей среды, окисляются, а сам окислитель восстанавливается. При этом металл из свободного состояния переходит в химические соединения – оксиды, сульфиды, гидроксиды. 4Fe + 3O2 + 6H2O = 4Fe(OH)3
Химически чистое железо почти не подвержено коррозии, а техническое железо, которое содержит различные примеси, ржавеет. Следовательно, одной из причин коррозии является наличие примесей в металле.

Возле города Дели в Индии находится железная колонна с очень маленькими пятнышками ржавчины, хотя её возраст почти 1700 лет. Это знаменитая Кутубская колонна высотой около семь м и массой шесть с половиной т. Согласно одной из гипотез, долговечность и коррозионная устойчивость колонны объясняются очень малым количеством различных примесей в железе и относительно невысокой влажностью, характерной для этой местности.

Например, если два различных металла, которые находятся в контакте между собой, опустить в водный раствор электролита (это могут быть грунтовые воды, сконденсированная влага из атмосферы), то металл более активный, расположенный в электрохимическом ряду напряжений левее, будет разрушаться, и тем самым предохранять менее активный металл от коррозии. Например, при контакте железа с медью в водной среде, железо, как более активный металл, постепенно коррозирует, переходя в воду в виде ионов железа. Таким образом, коррозия металла резко усиливается при соприкосновении его с менее активным металлом.

Образовавшиеся свободные электроны от атомов железа, перейдут к меди и на её поверхности соединяться с ионами водорода, которые образуются из компонентов водной среды (например, серной или других кислот). Этот электрохимический процесс можно представить так:
|
|
|
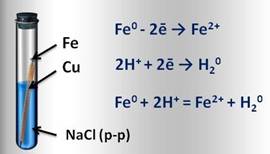
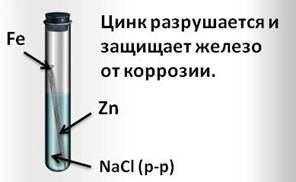
И, наоборот, при контакте железа с более активным цинком, цинк разрушается и защищает железо от коррозии.
|
|
|


