 |
Коллигативные свойства разбавленных растворов неэлектролитов
|
|
|
|
Коллигативными называются свойства, величина которых зависит только от количества частиц растворённого вещества. Измеряя одно из этих свойств можно вычислить все остальные. К количественным свойствам относятся: 1) понижение Р пара растворителя над раствором 2) повышение Т кипения разбавленного раствора по сравнению с температурой кипения чистого растворителя 3) понижение Т замерзания раствора по сравнению с Т замерзания чистого растворителя 4) осмотическое Р при постоянной Т давления насыщенного пара растворителя над раствором всегда ниже чем давление насыщенного пара над чистым растворителем  ,
,  – молярная доля растворителя в растворе
– молярная доля растворителя в растворе  . Относительное понижение давление пара растворителя над раствором равно молярной доле растворённого вещества. З. Рауля можно вывести используя Ур Дюгема – Маргулиса. Запишем закон Генри выражение концентрации растворённого вещества в молярных долях
. Относительное понижение давление пара растворителя над раствором равно молярной доле растворённого вещества. З. Рауля можно вывести используя Ур Дюгема – Маргулиса. Запишем закон Генри выражение концентрации растворённого вещества в молярных долях  ,
,  ;
;
продифференцировав по  при постоянстве Р и Т
при постоянстве Р и Т  (1).
(1).
В соотв. Ур Д – М.
 ,
, 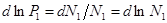 (2),
(2),  ,
,  ,
,  , то
, то 

Растворы кипят при Т более высокой чем чистый растворитель. Любая жидкость начинает кипеть при такой температуре, при которой давление её насыщенного пара становится равным внешнему давлению. В соответствии с з Рауля давление пара над раствором ниже, чем над чистым растворителем при той же температуре. Равенство давлений внешнего и пара над раствором достигается при более высокой Т.
 ,
,  ,
,  - моляльность, Е – эбуллиоскопическая константа, ОА – зависимость Р от Т для чистого растворителя, O’B– для раствора. Эбуллиоскопическая константа = повышению температуры кипения раствора в котором концентрация растворённого вещества = 1 моль/кг растворителя. При условии, что раствор сохраняет свойства разбавленного. Эбулеоскопической константой называется молярное повышение Т кипения. Е как и К зависит только от природы растворителя
- моляльность, Е – эбуллиоскопическая константа, ОА – зависимость Р от Т для чистого растворителя, O’B– для раствора. Эбуллиоскопическая константа = повышению температуры кипения раствора в котором концентрация растворённого вещества = 1 моль/кг растворителя. При условии, что раствор сохраняет свойства разбавленного. Эбулеоскопической константой называется молярное повышение Т кипения. Е как и К зависит только от природы растворителя  ,
,  – удельная теплота испарения растворителя. Измеренным
– удельная теплота испарения растворителя. Измеренным  можно вычислить молекулярную массу растворено го вещества
можно вычислить молекулярную массу растворено го вещества  ,
, 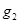 – масса растворённого вещества,
– масса растворённого вещества,  – масса растворителя
– масса растворителя  .
. 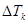 как правило < чем. точность определения молекулярной массы в значительной степени зависит от точного определения
как правило < чем. точность определения молекулярной массы в значительной степени зависит от точного определения 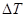 , то криоскопический метод является более предпочтительным.
, то криоскопический метод является более предпочтительным.
|
|
|

Любая жидкость начинает замерзать при такой Т при которой Р её насыщенного пара становится = давлению пара над твёрдым веществом. Т кристаллизации растворителя из раствора всегда ниже, чем Т кристаллизации чистого растворителя. 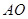 – зависимость Р над тв веществом,
– зависимость Р над тв веществом,  – Р пара над жидкостью.
– Р пара над жидкостью.  Установлено, что
Установлено, что  ,
,  - моляльная концентрация растворённого вещества,
- моляльная концентрация растворённого вещества,  - коэффициент пропорциональности. Это соотношение получается следующим образом. Запишем Ур Клауз-Клап для растворителя в тв и ж сост.
- коэффициент пропорциональности. Это соотношение получается следующим образом. Запишем Ур Клауз-Клап для растворителя в тв и ж сост.  (1),
(1),  ,
,  ,
,  численно равно понижению Т замерзания раствора 1 моляльной концентрации. Измеренной
численно равно понижению Т замерзания раствора 1 моляльной концентрации. Измеренной  раствора определённой концентрации можно вычислить молекулярную массу растворённого вещества
раствора определённой концентрации можно вычислить молекулярную массу растворённого вещества  .
.
Если раствор привести в контакт с чистым растворителем, через полупроницаемую мембрану способную пропускать только молекулы растворителя, то наблюдается самопроизвольный переход растворителя в раствор, это явление называется осмосом. Давление, с которым растворитель стремится перейти в раствор называется осмотическим давлением. По величине это давление = тому давлению, которое нужно приложить к раствору, что бы прекратить переход растворителя в раствор (чтобы привести его в равновесие). Для разбавленных растворов неэлектролитов Ванд Гофф нашел  . Осмотическое давление может иметь большие величины
. Осмотическое давление может иметь большие величины  . Это давление, которое производили бы молекулы находящиеся в состоянии идеального газа и занимая при той же температуре V=V раствора. Осмотическое давление учитывается в технологических процессах переработки растительного и животного сырья.
. Это давление, которое производили бы молекулы находящиеся в состоянии идеального газа и занимая при той же температуре V=V раствора. Осмотическое давление учитывается в технологических процессах переработки растительного и животного сырья.
|
|
|
|
|
|


