 |
Коллигативные свойства разбавленных растворов в случае диссоциации
|
|
|
|
Величина свойства зависит от количества частиц растворённого вещества в растворе, то это приводит к увеличению числа частиц этого вещества в растворе и к увеличению числа частиц этого вещества в растворе и к увеличению величины свойства. Для вычисления свойств растворов рассмотренных нами формулами  ,
,  ,
,  ,
,  вводят поправочный множитель, называемый изотоническим коэффициентом i. Несколько меньше, что объясняется взаимным притяжением частиц образованных при диссоциации. Для вычисления коллигативных свойств растворов в случае диссоциации растворов вещества используют
вводят поправочный множитель, называемый изотоническим коэффициентом i. Несколько меньше, что объясняется взаимным притяжением частиц образованных при диссоциации. Для вычисления коллигативных свойств растворов в случае диссоциации растворов вещества используют 
 – степень диссоциации,
– степень диссоциации, 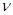 – число образовавшихся при диссоциации молекул.
– число образовавшихся при диссоциации молекул.
Закон распределения:
если в системе, состоящей из 2-ух несмешиваемых растворителей ввести 3-ее вещество которое способно растворить в обоих растворителях, то оно распределится м/у этими растворителями, т.о. чтобы отношение его концентрации в этих растворителях при постоянной температуре оставалось величиной постоянной независящей от количества введённого 3 –го компонента. 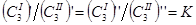 – коэффициент распределения,
– коэффициент распределения,  справедлив если растворы 3-го вещества в 1-ом и 2-ом растворителях можно считать разбавленными. Если растворы 3-го вещества в равновесных фазах нельзя считать идеальными, то константа распределения определяется как отношение активности 3-го вещества. З распределения легко получить из условий гетерогенного равновесия
справедлив если растворы 3-го вещества в 1-ом и 2-ом растворителях можно считать разбавленными. Если растворы 3-го вещества в равновесных фазах нельзя считать идеальными, то константа распределения определяется как отношение активности 3-го вещества. З распределения легко получить из условий гетерогенного равновесия 

 . Если распределяемое вещество при растворении в 1-ом и 2-ом растворителях диссоциирует или ассоциирует, то з. распределения
. Если распределяемое вещество при растворении в 1-ом и 2-ом растворителях диссоциирует или ассоциирует, то з. распределения 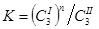 . Экстрагирование – метод извлечения растворённого вещества из раствора с помощью другого растворителя, который не смешивается и химически не реагирует с раствором, но растворять извлекаемое вещество в большем количестве чем первый растворитель. Экстракция широко используется.
. Экстрагирование – метод извлечения растворённого вещества из раствора с помощью другого растворителя, который не смешивается и химически не реагирует с раствором, но растворять извлекаемое вещество в большем количестве чем первый растворитель. Экстракция широко используется.
|
|
|
Используя закон распределения, можно рассчитать процесс экстрагирования. Пусть вещество подлежащее извлечению находится в растворе объёмом V в количестве, и пусть для извлечения его из раствора используют подходящий растворитель объёмом. Если к раствору объёмом V добавить растворитель 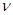 и смесь хорошо перемешать до наступления равновесия, то часть растворённого вещества из раствора перейдёт в растворитель. Обозначим количество извлечённого вещества оставшегося в растворе, тогда его концентрация в этом растворе
и смесь хорошо перемешать до наступления равновесия, то часть растворённого вещества из раствора перейдёт в растворитель. Обозначим количество извлечённого вещества оставшегося в растворе, тогда его концентрация в этом растворе 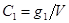 . Его концентрация в
. Его концентрация в 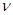
 . Коэффициент распределения
. Коэффициент распределения  .
.  Количество извлечённого вещества
Количество извлечённого вещества 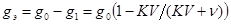 . Если отделить раствор с помощью делительной воронки, к оставшемуся раствору в котором извлечённого вещества добавить свежеприготовленного растворителя
. Если отделить раствор с помощью делительной воронки, к оставшемуся раствору в котором извлечённого вещества добавить свежеприготовленного растворителя 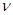 , то обозначим через количество растворённого вещества в растворе после второго экстрагирования. Будем иметь
, то обозначим через количество растворённого вещества в растворе после второго экстрагирования. Будем иметь  ;
;  ;
;  . Если экстрагировать n- раз
. Если экстрагировать n- раз  , где
, где  - количество извлекаемого вещества которое осталось в растворе V n-го после экстрагирования. Количество извлечённого вещества при этом определяется
- количество извлекаемого вещества которое осталось в растворе V n-го после экстрагирования. Количество извлечённого вещества при этом определяется  . если экстрагировать 1 раз, но V
. если экстрагировать 1 раз, но V  , то количество экстрагированного вещества определяется
, то количество экстрагированного вещества определяется  . Эффективнее экстрагировать
. Эффективнее экстрагировать  раз обьёмом V чем один раз -
раз обьёмом V чем один раз -  .
.
Совершенные растворы
Образуются в том случае, если компоненты весьма близки по своим физикохим. свойствам (растворы оптических изомеров, расплавы близких по свойствам природных веществ (Fe и Ni). Совершенные растворы, образованные без изменения V и без теплового эффекта. По этой причине V и Н бинарного совершенного раствора выражается уравнением: 
 , здесь и - молярный V 1-ого и 2-ого компонентов, а и - молярные энтальпии этих компонентов в чистом виде
, здесь и - молярный V 1-ого и 2-ого компонентов, а и - молярные энтальпии этих компонентов в чистом виде  ;
;  . Парциальный молярный V равен просто молярному V
. Парциальный молярный V равен просто молярному V  ;
;  т.к.
т.к.  то
то  , это означает, что тенденция к образованию такого раствора определяется увеличением энтропии
, это означает, что тенденция к образованию такого раствора определяется увеличением энтропии  . В отличии от величин Н и V величины G и S преобр. совершенного раствора не аддитивны. Энтропия S определяется отношением:
. В отличии от величин Н и V величины G и S преобр. совершенного раствора не аддитивны. Энтропия S определяется отношением:  ;
;  - энтропии чистых компонентов относящихся к 1 молю, а – изменение энтропии при смешении компонентов. Изменение энтропии при смешении 1 и 2 компонента определяется:
- энтропии чистых компонентов относящихся к 1 молю, а – изменение энтропии при смешении компонентов. Изменение энтропии при смешении 1 и 2 компонента определяется: 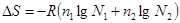 . Изменение энтропии при образовании 1 моля раствора
. Изменение энтропии при образовании 1 моля раствора  . Изменение G при образовании 1 моля раствора
. Изменение G при образовании 1 моля раствора  . Т к
. Т к 
 и
и  , то
, то  , то есть совершенный раствор образуется самопроизвольно при любых концентрациях, при любых соотношениях компонентов. Для любого компонента совершенного раствора хим. потенциал определяется
, то есть совершенный раствор образуется самопроизвольно при любых концентрациях, при любых соотношениях компонентов. Для любого компонента совершенного раствора хим. потенциал определяется  :. Для обоих компонентов бинарного совершенного раствора при любых его концентрациях соблюдается закон Рауля
:. Для обоих компонентов бинарного совершенного раствора при любых его концентрациях соблюдается закон Рауля  и
и  . Давление пара над раствором
. Давление пара над раствором 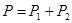 ;
;  . Как парциальное давление каждого компонента так и общее давление пара над раствором является линейной функцией состава.
. Как парциальное давление каждого компонента так и общее давление пара над раствором является линейной функцией состава.
|
|
|
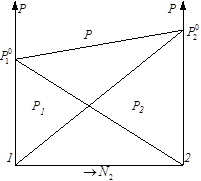
Чтобы построить диаграмму давление-состав для совершенного раствора, достаточно знать лишь давление насыщенного пара каждого из компонентов в чистом состоянии при данной температуре. В случае совершенного раствора легко определить состав пара над раствором. В общем случае составы равновесных жидкости и пара не совпадают. Обозначим и – молярные доли 1 и 2 компонента в насыщенном паре над раствором. По закону Рауля  и
и  . По закону Дальтона
. По закону Дальтона  и
и  , где –P общее давление пара над раствором
, где –P общее давление пара над раствором  а
а  . и
. и 
 Соответственно
Соответственно  по этим формулам можно подсчитать молярные доли компонентов в равновесной паре над совершенным раствором, если известен состав раствора. Сопоставив закон Рауля и Дальтона можно написать
по этим формулам можно подсчитать молярные доли компонентов в равновесной паре над совершенным раствором, если известен состав раствора. Сопоставив закон Рауля и Дальтона можно написать 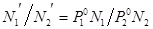 . Составы пара и жидкости будут одинаковы только тогда, когда будут равны давлению насыщенного пара компонентов в чистом состоянии, что бывает очень редко. Если
. Составы пара и жидкости будут одинаковы только тогда, когда будут равны давлению насыщенного пара компонентов в чистом состоянии, что бывает очень редко. Если  , то есть компонент первый при данной температуре более летуч, то пар будет обогащен по сравнению с жидкостью именно этим компонентом, то есть
, то есть компонент первый при данной температуре более летуч, то пар будет обогащен по сравнению с жидкостью именно этим компонентом, то есть  . В случае совершенных растворов пар всегда обогащен по сравнению с жидкостью компонентом, давление насыщенного пара которого выше, то есть более летучим компонентом.
. В случае совершенных растворов пар всегда обогащен по сравнению с жидкостью компонентом, давление насыщенного пара которого выше, то есть более летучим компонентом.
|
|
|
Реальные растворы
Образ реального сопровождается обычно тепловыми эффектами и изменением V т.е.  ,
,  реальные растворы обнаруживают отклонение от з. Рауюля. Если взаимод. м/у разнородными молекулами бинарного раствора (А и В) сильнее, чем взаимодействие м/у однородными молекулами, то образование раствора при смешении компонентов сопровождается уменьшением V системы и выделение теплоты. Такие растворы обнаруживают отрицательное отклонение от з Рауля (эфир-хлороформ). Диаграмма давление-состав в таких случаях:
реальные растворы обнаруживают отклонение от з. Рауюля. Если взаимод. м/у разнородными молекулами бинарного раствора (А и В) сильнее, чем взаимодействие м/у однородными молекулами, то образование раствора при смешении компонентов сопровождается уменьшением V системы и выделение теплоты. Такие растворы обнаруживают отрицательное отклонение от з Рауля (эфир-хлороформ). Диаграмма давление-состав в таких случаях:

в системе с отрицательным отклонением хим. потенциала компонента меньше чем они были бы в случае совершенного раствора того же состава. Если взаимодействие А В слабее чем взаимодействие А-А и В-В, то образование раствора при смешении компонентов сопровождается увеличением V и поглощение теплоты т.е  ,
,  . такие растворы обнаруживают положительное отклонение от з. Рауля.
. такие растворы обнаруживают положительное отклонение от з. Рауля.
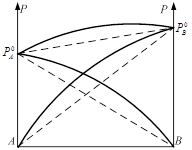
В системе с положительным отклонением от з Рауля хим. потенциал компонентов больше чем они были бы в случае совершенного раствора того же состава. Как положительное, так и отрицательное отклонение. Взаимодействие разнородных молекул А и В и однородных является процессом конкур. В зависимости от состояния раствора может преобладать как положительное, так и отрицательное отклонения. В качестве примера системы пиридин-вода. Отсутствие отклонения от закона Рауля или равенство нулю теплоты смешения при образовании раствора одного какого-либо состояния является признаком того, что данный компонент при смешении образует идеальный раствор.
|
|
|


