 |
Результат модификаций гистонов.
|
|
|
|
Гистоны синтезируются в цитоплазме, после чего транспортируются в ядро. Наиболее высокий уровень синтеза гистонов совпадает с S-фазой клеточного цикла, т.к. они необходимы клетке в этот период. Сразу после синтеза гистоны приобретают специфический модификационный паттерн и ассоциируются с шаперонами, которые облегчают их осаждение на ДНК.
Наиболее значительные изменения в структуре хроматина происходят во время транскрипции специфических генов, синтеза ДНК в течение S-фазы клеточного цикла и конденсации хромосом в течение митоза.
Ацетилирование. В новосинтезированных гистонах ацетилированы К5, К12 гистона Н4 и К18, К1 гистона Н3. В течение транспорта из цитоплазмы в ядро, гистоны приобретают дополнительные модификации (H3K9me, H3K56Ac).
Ацетилирование гистонов, как правило, ведет к активации транскрипции генов.
В транскрипционно активных областях хроматина высокое содержание моноацетилированных гистонов H3 и H4, что свидетельствует об их особой роли в процессе активации транскрипции. Моноацетилирование К6 – главная модификация гистона H4 в клетках животных. Удаление фермента, катализирующего модификацию H3K16 приводит к фрагментации ядра, что еще раз свидетельствует о важной роли этой модификации. Ацетилированные гистоны располагаются в области промотеров генов. Ацетилирование гистонов происходит быстрее, чем метилирование.
Метилирование. Метилированные гистоны (за исключением H3K4me) располагаются по всей области генов.
Метилирование гистонов играет наиболее значительную роль в создании эпигенетической информации, в то время как остальные модификации имеют модулирующую функцию (например, могут иметь роль сигнальных молекул для приема внешнего сигнала хроматином).
|
|
|
Фосфорилирование. Фософорилирование гистонов совпадает с началом митоза, который начинается с фосфорилирования линкерного гистона H1. Хвосты (N-концевые части) коровых гистонов подвергаются фосфорилированию во время деления клетки (Т3, S10, S28 гистона Н3 и S1 гистона Н4).
6. Объясните, каким образом эпигенетические модификации хроматина влияют на активность генов? Приведите примеры молекулярных механизмов? (в т.ч. см. МБ 5)
Эпигенетическая регуляция – процесс, приводящий к изменению активности гена без изменений его кодирующей последовательности.
В процессе развития многоклеточных организмов меняется активность генов - одни активны, другие неактивны (временно).
Эпигенетические модификации ( характеристика):
-обратимо изменяют экспрессию генов или фенотип клетки, изменяя доступность ДНК для транскрипции,
-не связаны с нарушением нуклеотидной последовательности ДНК,
-могут приводить к сохранению неактивного или активного состояния генов в ряду митотических делений соматических клеток, а также могут передаваться следующим клеточным поколениям,
-обусловлены работой специфических энзимов, но могут происходить «спонтанно» (без ферментов).
Типы ЭМ:
· ДНК-метилирование,
· модификации гистонов (ацетилирование, фосфорилирование, метилирование, АТФ-рибозилирование, сумоилирование, убиквитинирование),
· вариантные формы гистонов,
· ремоделлинг нуклеосомы – изменение позиции нуклеосомы АТФ-зависимым путем,
· РНК-интерференция, РНК-асссоциированное подавление транскрипции и трансляции (это не модификация хроматина, но тоже можно упомянуть об этом механизме).
1. Метилирование ДНК — обратимая ковалентная модификация ДНК, происходящая в результате присоединения метильной группы в 5-м положении цитозинового нуклеотида с образованием 5-метилцитозина.
|
|
|
 При присоединении ДНК-метилтрансферазы к ДНК водородные связи цитозина (цитозин метилируется значительно чаще, чем аденин) с комплементарным основанием гуанина (G) разрываются, СН3- присоединяется к цитозину в 5 положении. Затем водородные связи между 5-mC и G восстанавливаются.
При присоединении ДНК-метилтрансферазы к ДНК водородные связи цитозина (цитозин метилируется значительно чаще, чем аденин) с комплементарным основанием гуанина (G) разрываются, СН3- присоединяется к цитозину в 5 положении. Затем водородные связи между 5-mC и G восстанавливаются.
Цитозин метилируется, если рядом с ним находится гуанин (G) в сочетании CрG, где р - остаток фосфорной кислоты, связывающийся с сахарными остатками с образованием сахарофосфатного остова ДНК (CpG-динуклеотиды).
После репликации метилированной ДНК новообразованная цепь не будет метилированной. ДНК-метилтранфераза узнает и метилирует С, комлементарный G в новообразованной цепи - распределение метилированных оснований поддерживается при репликации ДНК.
Спонтанное дезаминирование С приводит к превращению в урацил, который устраняется спец ферментами и заменяется С вновь. Дезамин-е 5-mC приводит к тимину (при репликации GC пара превратится в АТ, что может привести к вредной мутации, закрепляемой при репликации ДНК).
Существует 2 группы ДНК-метилтранфераз: метилирует de novo, фермент, дометилирующий новообразованную цепь при репликации (поддерживающие метил-е).
Метилирование ДНК ведет к конденсации хроматина, не нарушает способность к комплементарному взаимодействию, препятствует взаимодействию регуляторных белков (факторов транскрипции -ФТ) с промотором и способствует привлечению к району промотора белков, подавляющих транскрипцию. Метильные группы нарушают ДНК-белковые взаимодействия, выступая в большую бороздку ДНК и препятствуя связыванию специфических транскрипционных факторов. Помимо этого, метилированные районы ДНК связывают methyl binding domain-содержащие белки, привлекающие транскрипционные репрессоры или белки, модифицирующие гистоны (Большинство MBD-содержащих белков – репрессоры или корепрессоры транскрипции (могут формировать комплексы с деацетилазами гистонов (репрессорами))).Гетерохроматин (транскрипционно инертный) характеризуется наличием метилированной, поздно реплицирующейся ДНК.
Однако в отдельных случаях метилирование может препятствовать взаимодействию участка ДНК с репрессорными белками, подавляющими активность гена и конкурирующими за связывание ДНК с белками, обеспечивающими транскрипцию гена. Некоторые транскрипционные факторы наоборот имеют повышенное сродство к метилированным сайтам.
|
|
|
Нарушение метилирования: гипометилирование может привести к активации протоонкогенов, генов ростовых факторов, гена активатора плазминогена урокиназного типа, гена гепараназы и кальций-связывающего протеина, способствующих метастазированию; чрезмерное метилирование генов-супрессоров, подавляющих злокачественный рост, - к развитию рака.
Метилированию в норме подвергается 2-7% цитозиновых остатков ДНК (в 70% случаев цитозин метилируется в составе динуклеотидов С-G (CpG). СpG участки обычно базируются в зонах промотеров).
Значение метилирования: - регуляция структуры хроматина и генной экспрессии, - сайленсинг повторяющихся и интегрированных чужеродных последовательностей ДНК, - формирование профиля экспрессии, характерного для данного типа клеток, - геномный импринтинг (активные гены определяются полом организма, от которого эти гены унаследованы, например, ген, пришедший от отца, сильнее метилирован и неактивен, тогда как гомологичный материнский ген активно транскрибируется), - инактивация одной Х-хромосомы у женщин, - канцерогенез (гиперметилирование генов-супрессоров, гипометилирование онкогенов, ФР).
2.  Ферментная ковалентная модификация гистонов (ацетилирование, метилирование, убиквитинирование, фосфорилирование):
Ферментная ковалентная модификация гистонов (ацетилирование, метилирование, убиквитинирование, фосфорилирование):
 Модификации N-хвостов гистонов происходит значительно чаще, чем остальных частей гистонов. Свободные «хвостовые» домены содержат аминокислоты лизин, аргинин, серин. Эти домены обладает + зарядом, и, взаимодействуя с отрицательно заряженными фосфатными группами цепи ДНК, определяют стабильность структуры нуклеосомы.
Модификации N-хвостов гистонов происходит значительно чаще, чем остальных частей гистонов. Свободные «хвостовые» домены содержат аминокислоты лизин, аргинин, серин. Эти домены обладает + зарядом, и, взаимодействуя с отрицательно заряженными фосфатными группами цепи ДНК, определяют стабильность структуры нуклеосомы.
 При изменении общего заряда белка и, соответственно, изменении структуры хроматина – освобождается доступ транскрипционных факторов к ДНК. Сочетание различных модификационных процессов создает т.н. «гистоновый код», во многом определяющий сущность и порядок считывания генетической информации, функциональное состояние участков генома.
При изменении общего заряда белка и, соответственно, изменении структуры хроматина – освобождается доступ транскрипционных факторов к ДНК. Сочетание различных модификационных процессов создает т.н. «гистоновый код», во многом определяющий сущность и порядок считывания генетической информации, функциональное состояние участков генома.
|
|
|
Модификации гистонов и зменяют электростатическое взаимодействие между гистонами и ДНК: либо понижают + заряд на хвостах гистонов, что приводит к их диссоциации от ДНК, либо способствуют связыванию белков, распознающими модифицированные гистоны.
Ацетилирование гистонов в области промотеров генов, как правило, ведет к активации транскрипции генов.
3. АТФ-зависимое ремоделирование хроматина – изменение связывания ДНК с гистонами (перемещение или удаление нуклеосом);
 Интенсивность экспрессии генов зависит от густоты расположения нуклеосом в активно экспрессирующихся участках генома. Ремоделирование хроматина — это процесс активного изменения «густоты» нуклеосом и сродства гистонов с ДНК.
Интенсивность экспрессии генов зависит от густоты расположения нуклеосом в активно экспрессирующихся участках генома. Ремоделирование хроматина — это процесс активного изменения «густоты» нуклеосом и сродства гистонов с ДНК.
Нуклеосомы могут быть собраны в состав хроматина или удалены, коровые гистоны могут быть заменены на вариантные, может быть изменена позиция нуклеосом по отношению к последовательности ДНК. АТФ-зависимые хроматин-ремоделирующие факторы - структурно и функционально различные белковые комплексы, но все они содержат белки из SNF2-семейства АТФаз (каталитич субъединица).
4. Включение в состав хроматина вариантных гистонов.
Для всех гистонов, кроме Н4, показано существование вариантных гистонов, которые могут заменять канонические в составе нуклеосом. Предполагается, что нарушения регуляции сборки хроматина, содержащего вариантные гистоны, может вести к возникновению онкологических заболеваний, устойчивости раковых клеток к лекарственным препаратам, стерильности, нарушений в ЦНС и быть связано со старением.
Механизм «эпигенетической памяти» клетки «запоминает» паттерн гистоновых модификаций и сохраняет его при делении.
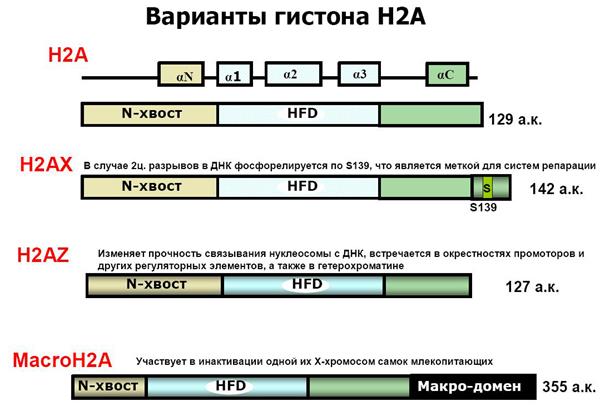
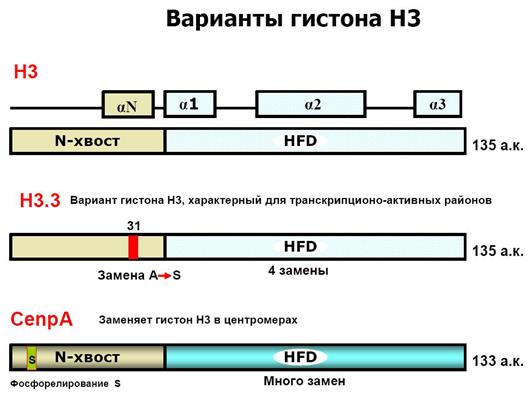 Включение вариантов гистонов H3 и H2A, например, H3.3, CENP-A или H2A.Z, в состав нуклеосом коррелирует с функциональной спецификацией регионов генома. В активно транскрибирующихся генах вместо гистона Н3 встраивается его вариант Н3.3. Гистон H3.3 может служить эпигенетической меткой, позволяющей поддерживать активное состояние экспрессии генов в ряду клеточных поколений. Положение центромеры в хромосомах и поддержание ее идентичности в ходе клеточных делений определяется эпигенетически с помощью цетромер-специфичного варианта гистона H3 – cenH3 (CENP-A).
Включение вариантов гистонов H3 и H2A, например, H3.3, CENP-A или H2A.Z, в состав нуклеосом коррелирует с функциональной спецификацией регионов генома. В активно транскрибирующихся генах вместо гистона Н3 встраивается его вариант Н3.3. Гистон H3.3 может служить эпигенетической меткой, позволяющей поддерживать активное состояние экспрессии генов в ряду клеточных поколений. Положение центромеры в хромосомах и поддержание ее идентичности в ходе клеточных делений определяется эпигенетически с помощью цетромер-специфичного варианта гистона H3 – cenH3 (CENP-A).
Вариантная форма гистона Н2А — H2AZ обнаруживается в нуклеосомах активно транскрибирующихся участков хроматина и предотвращает образование факультативного гетерохроматина.
5. РНК-ассоциированное подавление экспрессии генов
РНК-индуцированная ингибиция может осуществляться на различных этапах считывания генетической информации. Двухцепочечная молекула РНК расщепляется с помощью фермента Dicer на фрагменты длиной 21-25 нуклеотидов, образуя так называемую siRNA (small interfering RNA). Такие РНК способны образовывать комплексы с протеинами (RISC) и вызывать деградацию матричной РНК, то есть не допускать синтеза белка после успешного образования РНК (посттранскрипционная ингибиция).
|
|
|
Помимо этого имеет место быть РНК-зависимое метилирование ДНК и гистонов: siRNA имеют структуру, гомологичную промотерам ряда генов и способны индуцировать метилирование этих промотеров, присоединяясь к ним и активируя ДНК-метилтрансферазы.
Несколько возможных вариантов участия siRNA в ингибировании экспрессии генов: 1)прямое связывание РНК со специфическим транспортным белком Argonaute 2 и непосредственное связывание структуры с комплементарной последовательностью в промотере гена с дальнейшим включением механизма деацетилтрования гистонов и остановкой транскрипции.
2) опосредованное действие: связывание siRNA с известными репрессирующими комплексами – Mi2/NuRD и Sin3. Включают гистондеацетилазы и ДНК-метилтрансферазу, т.е. обладает способностью к метилированию ДНК и деацетилированию гистонов.


7.Опишите систему Cre-lox, объясните, как её можно использовать для кондиционного выключения генов?
Система рекомбинации Cre-lox используется для таргетинга, т.е. целенаправленного изменения определенных генов за счет гомологичной рекомбинации последовательностей, находящихся в хромосоме, с искусственно введенными в клетку последовательностями ДНК. Эту систему Cre-lox взяли от бактериофага Р1.
Если у клеток есть специальные сайты loxP, и они экспрессируют рекомбиназу Cre, то между сайтами loxP возможна рекомбинация (эти сайты могут специфически связывать эту рекомбиназу).

Рисунок 1. Сайты loxP состоят из 34 нуклеотидов. Две крайние части – это палиндромные последовательности (последовательность ДНК, состоящая из смежных инвертированных повторов, одинаково считывающихся и в левом направлении одной цепи, и в правом направлении другой цепи). А центральная часть асимметрична и может быть разной.
Cre вносит двухцепочечный разрыв ДНК, который потом зашивается ДНК-лигазой. Есть 3 возможных результата рекомбинации в зависимости от ориентации сайтов loxP:
1.Инверсия. Если два loxP сайта инвертированы, то произойдет инверсия гена между ними (при условии, что loxP находятся на одной хромосоме).
2.Делеция гена, если loxP сайты идут в прямой последовательности (при условии, что loxP находятся на одной хромосоме).
3.Транслокация, если loxP находятся на разных хромосомах.

Таким образом, можно нокаутировать какие-либо гены и смотреть, какое влияние оказало это выключение на организм животного. Таким образом, можно точно установить функцию каждого гена, а значит, понять механизмы нормального развития организма и формирования определяемых наследственностью заболеваний.
Нокаут с использованием системы Cre-lox называется кондиционный нокаут (или программируемый), т.е. нокаут при выполнении какого-то условия, этим условием и является наличие рекомбиназы Cre.
Использование стратегии "программируемого нокаута гена" требует создания двух линий мышей. Линия А несет интегрированную в геном последовательность гена Cre под контролем тканеспецифичного или индуцибельного промотора. Линия В содержит два loxP сайта, фланкирующих подлежащую удалению последовательность исследуемого гена. Следует отметить, что вставки в геномную последовательность loxP сайтов и гена Cre осуществляются с использованием тех же приемов, что и при классическом нокауте генов, но не должны затрагивать функциональные последовательности. Полученные таким образом гомозиготные линии мышей скрещивают. У потомков от этого скрещивания исследуемый ген будет инактивирован в ткани или группе клеток, где будет активен промотор, контролирующий активность гена Cre. Используя стратегию "программируемой инактивации гена", можно добиться результатов, недоступных при использовании стандартной процедуры нокаута генов.
На всякий случай кратко о традиционной схеме нокаута генов: получение векторной конструкции, с последующим внесением ее в культуру эмбриональных стволовых клеток (ЭСК) и отбор трансформантов. Трансформированные ЭСК вносят в зародыш, и полученных химерных животных скрещивают для получения линии мышей, гомозиготных по полученной мутации.
Почему кондиционный нокаут лучше? Потому что:
· Ген выключен только в присутствии активной рекомбиназы
· Можно контролировать включение и выключение
· Животное нормально развивается (это хорошо, так как при null-мутациях в традиционном подходе основная проблема – это летальность)
· Фенотип легче интерпретировать, так как ген можно выключить только в определенной популяции клеток.
Один из вариантов таргетинга, при котором происходит инактивация одного из генов с одновременным введением на его место другого функционирующего гена, получил название "knock-in".
1)В качестве вставки для “knockin” часто используют кДНК флуоресцентного белка (например, GFP –green fluorescent peptide). При этом все клетки, экспрессирующие измененный ген будут флуоресцентно мечеными. Это облегчает их выделение и детекцию в животном.
 2)Ещё один «популярный» вариант вставки – рекомбиназа Cre (часто в одной кассете с GFP), которая замещает кодирующую часть гена. Такой трюк позволяет не только нокаутировать ген в определенной популяции клеток, но и индуцировать в этой популяции нокаут других генов.
2)Ещё один «популярный» вариант вставки – рекомбиназа Cre (часто в одной кассете с GFP), которая замещает кодирующую часть гена. Такой трюк позволяет не только нокаутировать ген в определенной популяции клеток, но и индуцировать в этой популяции нокаут других генов.
Различные возможности кондиционного нокаута:
§ Возможна замена экзона гена на экзон с точечной аминокислотной заменой или любой другой мутацией
§ Вставка в 3’НТР гена кассеты с внутренним сайтом посадки рибосом позволяет создавать бицистронные аллели, не нарушая экспрессию изучаемого гена
§ Вырезание и рекомбинацию можно сделать направленной, чтобы объединять фрагменты разных молекул
§ Схема с тремя сайтами loxP, которая позволяет включать экспрессию маркера при делеции гена (т.н. нокаут-репортер)
§ Индуцируемый нокаут
§ Включение/выключение гена или трансгена при активации Cre и т.д.
|
|
|


