 |
Что такое система редактирования генома CRISPR-Cas9, каким образом её можно использовать в исследовательских и медицинских целях?
|
|
|
|
CRISPR/Cas9 – технология редактирования генома высших организмов, базируюшаяся на иммунной системе бактерий. В 1987 году японские ученые частично секвенировали геном E. Coli и обнаружили в ДНК участок, содержащий повторяющиеся последовательности ДНК (≈29 нуклеотидов, повторяющихся 13-14 раз), разделенные вариабельными участками — спейсерами. Подобные «кассеты» повторов и спейсеров названы позднее CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) - короткие палиндромные повторы, регулярно расположенные группами. В 2002 году были открыты гены cas — гены локусов CRISPR, кодирующие белки Cas. В 2005 году Мохика и его коллеги опубликовали результаты своих новых исследований, в которых было установлено, что спейсеры соответствуют последовательностям из геномов бактериофагов, а также участкам плазмид. Спейсеры заимствуются из чужеродных генетических элементов, с которыми сталкивалась клетка. В начале 2000-х годов группа биоинформатика Евгения Кунина предложила гипотетическую схему механизма действия CRISPR/Cas-систем. Согласно их модели, при попадании вируса в клетку он обнаруживается с помощью белка Cas, использующего синтезированную c CRISPR РНК-копию. Если какой-либо фрагмент генома вируса совпал с записанным в спейсере, Cas разрезает вирусную ДНК и запускает цепь реакций, в результате вся ДНК уничтожается.

Общие принципы:
Локусы CRISPR: 1) Короткие палиндромные повторы 30-40 нуклеотидов; 2) Спейсеры, длина сопоставима с длиной повторов; 3) гены CAS. Между генами CAS и рядом повторов-спейсеров расположена лидерная последовательность, содержащая промотор, с которого начинается однонаправленная транскрипция повторов и спейсеров CRISPR. Спейсеры полностью интегрированы в геном клетки и передаются её потомкам при делении.
|
|
|
Этапы CRISPR-опосредованного адаптивного иммунитета: адаптация, экспрессия и интерференция. На этапе адаптации в CRISPR встраивается новый спейсер, образованный из инородного генетического элемента, проникшего в клетку. На стадии экспрессии происходят транскрипция CRISPR и процессинг коротких CRISPR-РНК (crРНК), нацеленных на определённую мишень. В ходе интерференции рибонуклеопротеиновый комплекс crРНК-Cas распознаёт нуклеиновую кислоту-мишень за счёт комплементарного спаривания оснований мишени с crРНК, после чего разрезает мишень благодаря эндо- и/или экзонуклеазной активности белков Cas. Система CRISPR/CAS9 относится ко II классу, имеется только 1 эффекторный белок (эндонуклеаза CAS9). В системах этого типа в качестве направляющей РНК выступает не одна crРНК, а дуплекс crРНК и дополнительной РНК — tracrРНК. Дуплекс crРНК:tracrРНК направляет никазные домены RuvC и HNH Cas9 для внесения разрывов с образованием тупых концов в ДНК-мишени, которая должна иметь PAM около 3'-конца (чтобы не нацеливаться на спейсеры в собственном геноме и не разрушать его).
 Транскрипция пре- crРНК происходит в бактериальной клетке постоянно на низком уровне и усиливается при стрессовом воздействии (в тч вторжении вируса). Биогенез crРНК в системах II типа имеет ряд уникальных особенностей. В частности, для него необходим процессинг РНКазой III и связывание с пре-crРНК особых транс -кодируемых CRISPR-РНК (tracrРНК). В составе tracrРНК присутствует участок, комплементарный той области crРНК, которая была транскрибирована с повтора CRISPR. В ходе процессинга crРНК tracrРНК связывается с ещё не вырезанными crРНК в составе пре-crРНК, благодаря чему образуются зрелые crРНК. Первый этап процессинга пре-crРНК происходит в областях, комплементарных повторам CRISPR; в результате образуется 3'-конец crРНК. Последующая стадия обрезания 5'-конца неизвестными нуклеазами происходит внутри последовательностей, соответствующих спейсерам CRIPSR, образуется 5'-конец crРНК. Для накопления crРНК в клетках необходим белок Cas9, хотя неизвестно, вызвано ли это участием Cas9 в процессинге crРНК или стабилизацией crРНК при помощи Cas9 после процессинга, или же и тем, и другим. Получающийся в результате зрелый комплекс crРНК-tracrРНК-Cas9 содержит короткую crРНК, у которой 20—24 нуклеотида комплементарны 3'-концу спейсера и 20—24 нуклеотида комплементарны 5'-концу повтора. Комплекс crРНК-tracrРНК-Cas9 распознаёт ДНК-мишени, комплементарные crРНК и содержащие РАМ. Как и в системах I типа, отсутствие РАМ в локусах CRISPR предохраняет клеточную ДНК от разрезания. Сначала Cas9 распознаёт РАМ, а после этого прилегающая ДНК проверяется на комплементарность crРНК. Разрезание ДНК-мишени осуществляется путём внесения двух одноцепочечных разрывов мотивами RuvC и HNH белка Cas9, в результате чего образуется двуцепочечный разрыв с тупыми концами в ближнем к РАМ конце протоспейсера в R-петле, за три нуклеотида до РАМ. Место разрыва, таким образом, определяется малой РНК.
Транскрипция пре- crРНК происходит в бактериальной клетке постоянно на низком уровне и усиливается при стрессовом воздействии (в тч вторжении вируса). Биогенез crРНК в системах II типа имеет ряд уникальных особенностей. В частности, для него необходим процессинг РНКазой III и связывание с пре-crРНК особых транс -кодируемых CRISPR-РНК (tracrРНК). В составе tracrРНК присутствует участок, комплементарный той области crРНК, которая была транскрибирована с повтора CRISPR. В ходе процессинга crРНК tracrРНК связывается с ещё не вырезанными crРНК в составе пре-crРНК, благодаря чему образуются зрелые crРНК. Первый этап процессинга пре-crРНК происходит в областях, комплементарных повторам CRISPR; в результате образуется 3'-конец crРНК. Последующая стадия обрезания 5'-конца неизвестными нуклеазами происходит внутри последовательностей, соответствующих спейсерам CRIPSR, образуется 5'-конец crРНК. Для накопления crРНК в клетках необходим белок Cas9, хотя неизвестно, вызвано ли это участием Cas9 в процессинге crРНК или стабилизацией crРНК при помощи Cas9 после процессинга, или же и тем, и другим. Получающийся в результате зрелый комплекс crРНК-tracrРНК-Cas9 содержит короткую crРНК, у которой 20—24 нуклеотида комплементарны 3'-концу спейсера и 20—24 нуклеотида комплементарны 5'-концу повтора. Комплекс crРНК-tracrРНК-Cas9 распознаёт ДНК-мишени, комплементарные crРНК и содержащие РАМ. Как и в системах I типа, отсутствие РАМ в локусах CRISPR предохраняет клеточную ДНК от разрезания. Сначала Cas9 распознаёт РАМ, а после этого прилегающая ДНК проверяется на комплементарность crРНК. Разрезание ДНК-мишени осуществляется путём внесения двух одноцепочечных разрывов мотивами RuvC и HNH белка Cas9, в результате чего образуется двуцепочечный разрыв с тупыми концами в ближнем к РАМ конце протоспейсера в R-петле, за три нуклеотида до РАМ. Место разрыва, таким образом, определяется малой РНК.
|
|
|
Использование технологии для редактирования генома:
При редактировании генома эукариот результатом работы CRISPR-Cas9 является не разрушение всей молекулы ДНК, а репарация двуцепочечного разрыва, произведённого Cas9. Репарация может проводиться:
- за счет негомологичного соединения концов (NHEJ) (возникают небольшие вставки и делеции, разрушающие рамку считывания белок-кодирующих генов, что приводит к утрате функции гена-мишени, за счет множественных двухцепочечных возможно появление крупных делеций и инверсий);
 - путем гомологичной рекомбинации ( замена удалённой последовательности новой последовательностью, комплементарной матрице для репарации, которую создаёт сам исследователь), может использоваться для удаления нежелательных мутаций, создания новых аллелей, вставки или слияния функциональных доменов. инактивация доменов RuvC или HNH Cas9 превращает этот белок в РНК -направляемую никазу, производящую не двуцепочечные, а одноцепочечные разрывы. Инактивация обоих доменов превращает Cas9 в направляемый РНК ДНК-связывающий белок, не разрезающий мишень. В этом случае к ДНК-связывающему домену можно присоединить домен с другими функциями, что, в свою очередь, может вызвать различные изменения в локусе-мишени: активацию или репрессию транскрипции, модификацию хроматина, усиление образования петель и многие другие. Кроме того, инактивированная форма Cas9 (dCas9, «мёртвая» Cas9) служит основой для новых исследовательских приёмов — например, визуализации посредством флуоресценции или создания меток для последующей физической изоляции локусов.
- путем гомологичной рекомбинации ( замена удалённой последовательности новой последовательностью, комплементарной матрице для репарации, которую создаёт сам исследователь), может использоваться для удаления нежелательных мутаций, создания новых аллелей, вставки или слияния функциональных доменов. инактивация доменов RuvC или HNH Cas9 превращает этот белок в РНК -направляемую никазу, производящую не двуцепочечные, а одноцепочечные разрывы. Инактивация обоих доменов превращает Cas9 в направляемый РНК ДНК-связывающий белок, не разрезающий мишень. В этом случае к ДНК-связывающему домену можно присоединить домен с другими функциями, что, в свою очередь, может вызвать различные изменения в локусе-мишени: активацию или репрессию транскрипции, модификацию хроматина, усиление образования петель и многие другие. Кроме того, инактивированная форма Cas9 (dCas9, «мёртвая» Cas9) служит основой для новых исследовательских приёмов — например, визуализации посредством флуоресценции или создания меток для последующей физической изоляции локусов.
|
|
|

В настоящий момент для редактирования генома применяют систему CRISPR-Cas II типа, причём чаще всего используется белок SpyCas9 (нуклеаза Cas9 бактерии S. pyogenes).
- crРНК и tracrРНК, транскрибируемые отдельно (четырехкомпонентная система РНКаза III:crРНК:tracrРНК:Cas9)
- двухкомпонентная система sgРНК:Cas9 – используется чаще
 Доставка sgРНК:Cas9: трансфекцияклеток плазмидами, кодирующими sgРНК и Cas9 методом электропорации или плазмидами, кодирующими Cas9, а РНК доставлять в виде наработанных с помощью ПЦР ампликонов. Новый способ (2015): «наноклубок» состоящий из одной цепи ДНК, один из участков которой комплементарен sgРНК, т.о. комплекс sgРНК:Саs9 закрепляется внутри клубка. При контакте с клеткой наноклубок попадает в эндосому, полимер, покрывающий клубок разрушается и даёт возможность sgРНК:Cas9 достичь ядра. Кроме того применяются SaCas9 (Cas9 из Staphylococcus aureus ), малый размер позволяет упаковывать её в аденоассоциированный вирус (AAV) для доставки вектора в клетки живого организма в качестве терапевтического средства.
Доставка sgРНК:Cas9: трансфекцияклеток плазмидами, кодирующими sgРНК и Cas9 методом электропорации или плазмидами, кодирующими Cas9, а РНК доставлять в виде наработанных с помощью ПЦР ампликонов. Новый способ (2015): «наноклубок» состоящий из одной цепи ДНК, один из участков которой комплементарен sgРНК, т.о. комплекс sgРНК:Саs9 закрепляется внутри клубка. При контакте с клеткой наноклубок попадает в эндосому, полимер, покрывающий клубок разрушается и даёт возможность sgРНК:Cas9 достичь ядра. Кроме того применяются SaCas9 (Cas9 из Staphylococcus aureus ), малый размер позволяет упаковывать её в аденоассоциированный вирус (AAV) для доставки вектора в клетки живого организма в качестве терапевтического средства.
dCas9 (неспособная к разрезанию ДНК форма Cas9):
- для метода CASFISH (флуоресцентной гибридизации in situ)
- для подавления или активации транскрипции гена-мишени
Метод самоклонирующихся CRISPR:
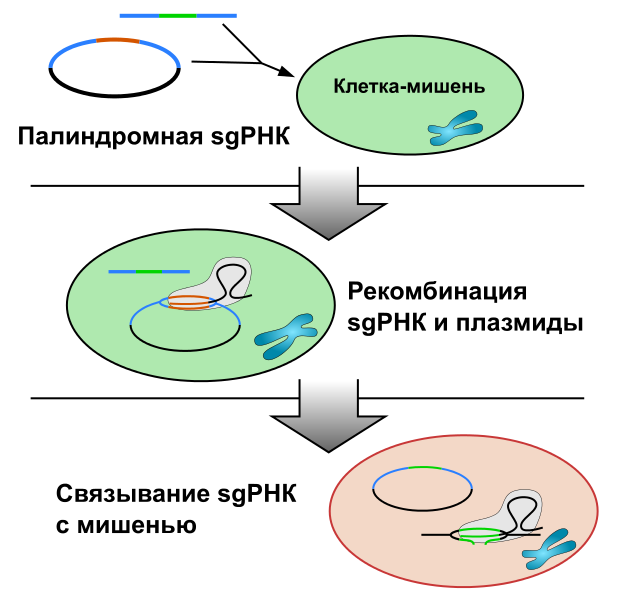
В этом случае в клетки вводят плазмиду, содержащую самоклонирующуюся палиндромную sgРНК, а также короткую двуцепочечную ДНК, которая содержит последовательность, кодирующую требуемую sgРНК. Когда плазмида транскрибируется, образующаяся sgРНК в комплексе с Cas9 комплементарно связывается с последовательностью в плазмиде, кодирующей эту sgРНК. Cas9 вносит двуцепочечный разрыв, который репарируется путём гомологичной рекомбинации с использованием введённой двуцепочечной ДНК в качестве матрицы; в итоге плазмида вновь содержит последовательность, кодирующую требуемую sgРНК. В отличие от стандартного метода CRISPR, для которого требуется длительная и трудоёмкая наработка специальных плазмид для каждого нового локуса-мишени, метод самоклонирующихся CRISPR позволяет сократить время эксперимента с шести дней до трёх часов и уменьшить его стоимость в шесть раз.
|
|
|
Применение:
- генная инженерия эукариот: растений, грибов, модельных организмов ( мышей, плодовой мушки Drosophila melanogaster, нематоды Caenorhabditis elegans, рыбки данио-рерио )
- В 2013 году исследователи сумели отредактировать аномальный ген в стволовых клетках пациента, больного муковисцидозом
- 2016 года в Китае было произведено редактирование генома взрослого человека с помощью CRISPR/Cas: пациенту с раком лёгких ввели модифицированные с помощью CRISPR-Cas Т-лимфоциты.
- в 2015 редактирование генома человеческого эмбриона: в оплодотворенную яйцеклетку с бета-талассемией введен белок Cas9 и sgРНК, исправление путем репарации по здоровой матрице. В 5–10% эмбрионов мутация, ответственная за возникновение болезни у взрослых людей, действительно была исправлена, однако это привело к множеству мутаций. точное редактирование получается, когда участок ДНК-мишени длиной чуть больше 20 нуклеотидов комплементарно взаимодействует с полностью соответствующим ему РНК-гидом, но последовательность-мишень в геноме вариабельна.
- нерешенные проблемы: откуда берутся спейсеры?, их эволюционно происхождение?, молекулярный механизм распознавания мишени?
9. Расскажите, что информация о модификации хроматина может нам сказать об активности генов? Какие методические приемы исследования хроматина получили широкое распространение?
Преобразования хроматина осуществляется с помощью трех основных взаимосвязанных механизмов:
1. ковалентной модификации гистонов,
2. АТФ-зависимого ремоделирования хроматина
3. включение вариантных гистонов в хроматин.

Посттрансляционные модификации гистонов могут определять дальнейшую судьбу клетки [6]. Например, фосфорилирование остатков серина в положении 10 и 28 гистона НЗ является маркером низкой транскрипционной активности. Комбинация фосфорилирования серина в положении 10 и ацетилирования лизина в положении 14 гистона НЗ является признаком активной транскрипции. В целом, предполагается, что множественные модификации, имеющие место в определенных местах гистонов представляют собой код, который влияет на то, какие белки способны взаимодействовать с комплексами гистонов и ДНК и, следовательно, какие гены регулируются этими белками [18]; [8]; [19].
|
|
|
Кроме того существует так называемая «эпигенетическая память». Это означает, что клетка «запоминает» паттерн гистоновых модификаций и способна сохранять его при делении [20]; [21]. При нарушении передачи информации гистонового кода или при сбое в его реализации могут возникать тяжёлые нарушения не только на клеточном уровне, но и серьёзные патологии на организменном уровне
Цитогенетический метод: Половой хроматин, впервые выявленный в ядрах нервных клеток кошек (Барр, Бертрам), представляет собой X хромосому в неактивном состоянии, располагающуюся под ядерной оболочкой. Половой хроматин выявляется (положителен) только при наличии не менее двух X хромосом в кариотипе, так как одна из них всегда активна. Увеличение количества хромосом в кариотипе сопровождается увеличением числа хроматиновых телец, которое всегда меньше на одну X хромосому, при сопоставлении его с количеством X хромосом. Половой хроматин можно исследовать в ядрах эпителия слизистой оболочки полости рта, влагалища, клетках тканей, опухолях, клетках амниотической жидкости (с целью определения генетического пола плода), лейкоцитах. Наиболее удобным является метод Сандерсона — определение полового хроматина в ядрах эпителия слизистой оболочки полости рта. При помощи шпателя делают соскоб с внутренней поверхности щек и наносят его на предметное стекло. Препарат фиксируют уксуснокислым арсеином, который окрашивает ядерные структуры, и микроскопируют. Хроматиновые тельца прилегают к ядерной оболочке. При различных аномалиях полового развития исследование полового хроматина позволяет выявлять несоответствие между фенотипом и генетическим полом больных, что способствует правильной диагностике заболевания.
10. Объясните, каким образом малые РНК можно доставить в клетки эукариот?
Самым главным препятствием на пути разработки лекарств из siRNA являются сложности с их доставкой в нужные клетки внутри целого организма (клетками-мишеням).
Во-первых, в крови на них действует первый эшелон защиты организма, ферменты - нуклеазы, которые разрезают потенциально опасные и необычные для нашего организма двойные цепочки РНК. Во-вторых, несмотря на свое название, малые РНК все же достаточно длинны, а, главное, они несут электростатический заряд, что делает невозможным их пассивное проникновение в клетку. И в - третьих, один из самых главных вопросов состоит в том, как заставить siRNA работать (или проникать) только в определенные ("больные") клетки, не затронув при этом здоровых?
В настоящее время применяется несколько способов доставки агентов на основе микроРНК в экспериментальных животных моделях и системах культивации in vitro.
· Прямая инъекция в клетку
Одним из распространенных способов является системная доставка посредством внутривенного или подкожного введения раствора олигонуклеотида в физиологическом буфере. В течение нескольких часов после введения уровни микроРНК в плазме уменьшаются за счет поглощения их клетками. При этом высокая метаболическая стабильность синтетических олигонуклеотидов позволяет им находиться в функциональном состоянии в тканях в течение нескольких недель. Эффекты от введения микроРНК проявляются не сразу, что, вероятно, обусловлено необходимостью запуска или выключения множества последовательных регуляторных событий, которые контролируются эндогенными микроРНК.
· Плазмидные конструкции
Одной из систем доставки микроРНК являются вирусные вектора, кодирующие предшественники микроРНК. В этом случае для созревания функциональной короткой двунитиевой РНК необходим дополнительный внутриклеточный процессинг транскрипта предшественника с участием белков Drosha и Dicer. Преимуществом этого метода доставки является высокая эффективность трансфекции и продолжительная экспрессия экзогенной микроРНК. Ограничивает использование векторных конструкций трудоемкость их изготовления, а также сложности, связанные с иммуногенностью и токсичностью.
· Липосомы
Альтернативным способом является непосредственная доставка синтетических коротких одно- нитевых ингибиторов микроРНК или двунитевых аналогов микроРНК. В этом случае доставка может быть опосредована каким-либо носителем, например, липосомами. Широкое применение липосом для доставки малых РНК связано с их оптимальным размером (около 100 нм), хорошей биосовместимостью, а также простотой получения и использования. Особое внимание уделяется разработке способов направленной доставки микроРНК. Для этого поверхности носителей покрывают тканеспецифичными лигандами. Высокая стабильность модифицированных синтетических олигонуклеотидов позволяет доставлять их в клетки и без носителя. Синтетические олигонуклеотиды без носителя могут применяться в культурах клеток. Показано, что LNA-модифицированные фосфотиоатные олигонуклеотиды эффективно поглощаются клетками in vitro и участвуют в специфичной регуляции генов. Использование этого метода позволяет избежать возможного побочного воздействия реагентов для трансфекции на исследуемую систему.
· Наночастицы
Комплексы малых РНК с катионными полимерами – полиплексы. Считают, что ПЭИ и другие катионные полимеры увеличивают проницаемость мембраны клетки путем создания в ней короткоживущих наноотверстий. Полагают также, что дестабилизирующее действие на мембраны может быть причи- ной цитотоксичности. В качестве транспортеров малых РНК широко применяют комплексы на основе сополимера молочной и гликолевой кислот (poly(lactic-co-glycolic acid) – PLGA). К их преимуществам относят малый размер, низкую цитотоксичность и способность к длительной циркуляции в кровотоке.
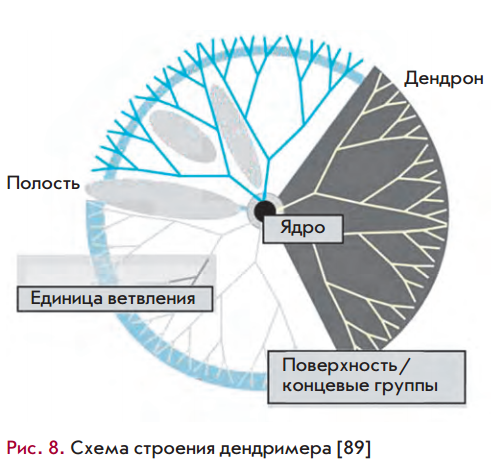 Дендримеры, также применяемые для доставки терапевтических олигонуклеотидов, представляют собой сильно разветвленные полимерные молекулы размером 1–5 нм. Переносимое вещество может быть соединено с периферическими группами дендримеров либо через ковалентную связь, либо путем ионных взаимодействий, они также могут быть инкапсулированы внутри дендримерных частиц, формируя мономолекулярные мицеллы. Конъюгаты, образованные дендримерами и переносимыми веществами, более устойчивы, чем липосомы.
Дендримеры, также применяемые для доставки терапевтических олигонуклеотидов, представляют собой сильно разветвленные полимерные молекулы размером 1–5 нм. Переносимое вещество может быть соединено с периферическими группами дендримеров либо через ковалентную связь, либо путем ионных взаимодействий, они также могут быть инкапсулированы внутри дендримерных частиц, формируя мономолекулярные мицеллы. Конъюгаты, образованные дендримерами и переносимыми веществами, более устойчивы, чем липосомы.
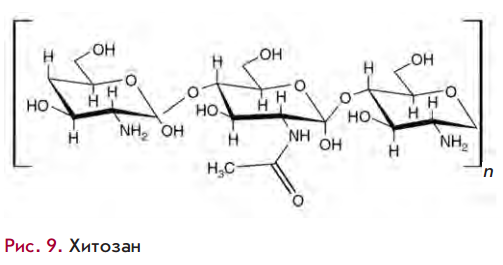 Доставка с помощью наночастиц природного полисахарида хитозана. Этот полимер практически нетоксичен для млекопитающих. Как правило, размер комплексов хитозан·малаяРНК не превышает 200 нм, что является преимуществом при доставке in vivo.
Доставка с помощью наночастиц природного полисахарида хитозана. Этот полимер практически нетоксичен для млекопитающих. Как правило, размер комплексов хитозан·малаяРНК не превышает 200 нм, что является преимуществом при доставке in vivo.
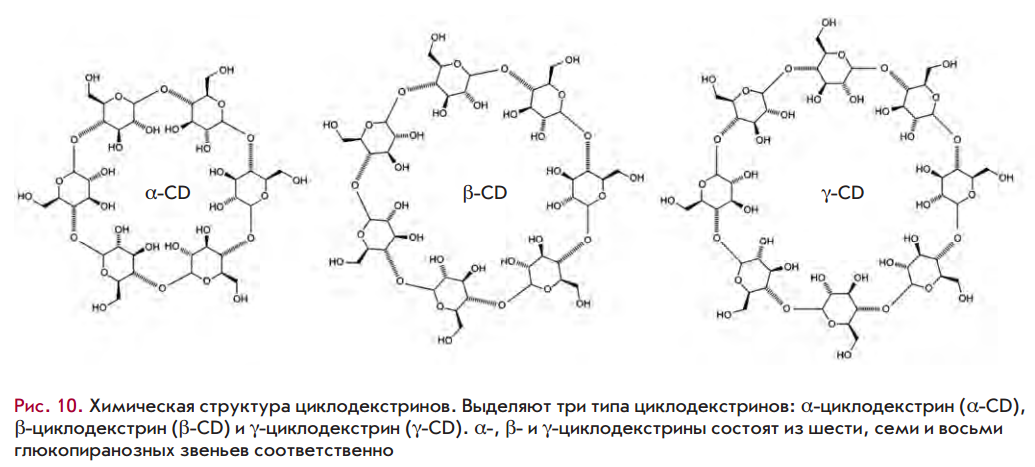 Циклодекстрины также применяют для доставки малых РНК. Они состоят из гидрофобной центральной полости и гидрофильной наружной поверхности. Циклодекстрины защищают малые РНК от де- градации нуклеазами сыворотки крови и снижают иммуногенность малых РНК in vivo,
Циклодекстрины также применяют для доставки малых РНК. Они состоят из гидрофобной центральной полости и гидрофильной наружной поверхности. Циклодекстрины защищают малые РНК от де- градации нуклеазами сыворотки крови и снижают иммуногенность малых РНК in vivo,
Неорганические наночастицы – углеродные нанотрубки, квантовые точки, наночастицы золота и др. – представляют собой альтернативные средства доставки малых РНК. Такие наночастицы отличаются от органических структурой, размерами, физическими и химическими свойствами, также они легко поддаются функционализации. Эти материалы воспроизводят структурные свойства высокомолекулярных полимеров, обладая при этом малой молекулярной массой.
· Микрочастицы (передача от клетки к клетке)
Транспортерами микроРНК могут быть и различные микрочастицы - микровезикулы, эндосомы, липопротеиды, апоптозные тела. Обмен микроРНК между клетками – важный способ межклеточной коммуникации! МСК способны передавать микроРНК (и мРНК) другим типам клеток с помощью внеклеточных везикул.

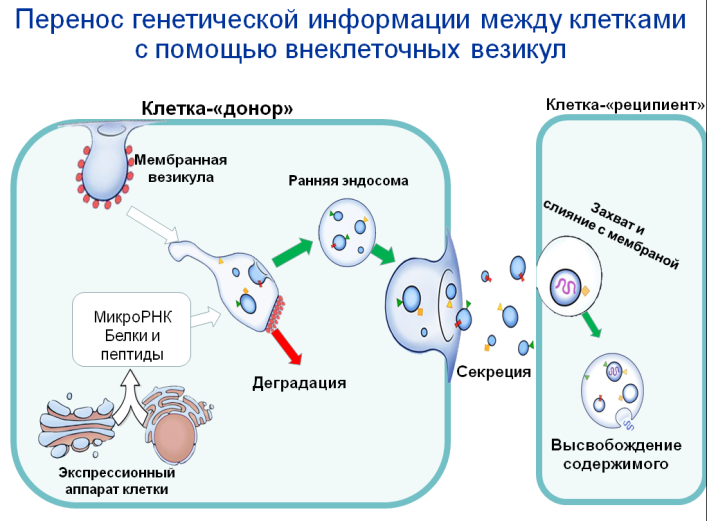
|
|
|


