 |
48. Физическое состояние почвенных коллоидов (золь и гель). Коагуляция и пептизация. Лиотропный ряд катионов. Гидрофильные и гидрофобные коллоиды.
|
|
|
|
48. Физическое состояние почвенных коллоидов (золь и гель). Коагуляция и пептизация. Лиотропный ряд катионов. Гидрофильные и гидрофобные коллоиды.
Коллоиды в почве находятся, главным образом, в виде гелей, в которых частицы сцепляются между собой и образуют пространственную структурную сетку, в ячейках которой удерживается вода.
Во влажной почве небольшое количество коллоидов может находиться в состоянии золя (то есть частицы разделены водной фазой), так называемой гидратационной оболочкой. Существование золя объясняется тем, что заряженные частицы отталкиваются друг от друга и могут долго находиться в суспензии, не образуя, осадка.
При хаотичном движении, падении электрического потенциала и уменьшении заряда частиц разноименно заряженных коллоидов они склеиваются, увеличиваются в размерах и выпадают в осадок. Процесс соединения коллоидных частиц и образование геля из золя называется коагуляцией, а дальнейшее осаждение – седиментацией. Переход коллоида от состояния геля в состояние золя называется пептизацией.
Взаимодействию и соединению коллоидных частиц мешают водные пленки, которые удерживаются на их поверхности. По количеству воды, удерживаемой коллоидами, они разделяются на гидрофильные и гидрофобные. Гидрофильные коллоиды сильно гидратированы, труднее коагулируют.
К ним относятся некоторые органические вещества почвы и минералы монтмориллонитовой группы. Гидрофобные коллоиды содержат небольшое количество воды. К ним относятся Fе(OH)3 и минералы каолинитовой группы.
Часть коллоидов находится в почве в свободном состоянии, часть образует пленки на поверхности более крупных гранулометрических фракций путем адгезии, под которой понимается слипание (склеивание) соприкасающихся друг с другом поверхностей каких-либо веществ различного химического состава. Таким путем в почве при периодическом высушивании, приводящем к дегидратации коллоидов, происходит закрепление гумусовых кислот и их солей на поверхности коллоидных частиц, а минеральных, органических и органоминеральных коллоидов – на поверхности частиц пылеватых и песчаных гранулометрических фракций.
|
|
|
49. Реакция почв. Кислотность и щелочность почв, их виды. Способы оптимизации реакции почв (известкование и гипсование).
Почва обладает определенной реакцией, которая проявляется при взаимодействии с водой или растворами солей. Реакция почвы может быть нейтральной, кислой или щелочной. Эти свойства почвы имеют чрезвычайно важное значение для роста и развития растений, так как каждый вид растений лучше всего развивается при определенной реакции почвы.
Кислотность почвы– способность почвы подкислять воду и растворы солей. Различают два вида почвенной кислотности: актуальную и потенциальную. Актуальная кислотность характеризует активность свободных ионов Н+ в почвенном растворе и вызвана наличием в нем свободных кислот, гиролитически кислых солей и степенью их диссоциации. Для многих почв кислотность определяется содержанием угольной кислоты и её солей.
Потенциальная кислотность определяется количеством Н+иAl3+, находящихся в ППК. Это кислотность твердой фазы почвы. Потенциальная кислотность подразделяется на обменную и гидролитическую.
Обменная кислотность определяется количеством поглощенных Н+иAl3+, вытесняемых из почвы катионами нейтральных солей: [ППК] Mg2+ + 4КCl↔ [ППК]Mg2++AlCl3 +HCl
Гидролитическая кислотность определяется количеством поглощенных ионов Н+иAl3+, вытесняемых гидролитически щелочной солью СН3СООNa(ацетат натрия): [ППК] H+ + 4СН3СООNa+ 3H2O→ [ППК]4Na+ + 4СН3СООH+Al(OH)3↓
|
|
|
Количество образующейся уксусной кислоты, эквивалентное количеству поглощенных водорода и алюминия в почве, определяет величину гидролитической кислотности.
Щелочность почвразличают актуальную и потенциальную.
Актуальная щелочность обусловлена наличием в почве гидролитически щелочных солей Na2CO3, NaHCO3, Ca(HCO3)2и др. При их диссоциации повышается содержание ОН–ионов: Na2CO3+ 2НОН ↔ Н2CO3 + 2Na++ 2ОН–
Потенциальная щелочность обусловлена содержанием обменно-поглощенного Na+, который может переходить в раствор и подщелачивать его.
[ППК] Na+ + Н2CO3 ↔ [ППК] Н+ +Na2CO3
Сильная щелочность или кислотность оказывает неблагоприятное действие на развитие растений и микроорганизмов, усиливает пептизацию почвенных коллоидов, ухудшает структурное состояние почвы и её физические свойства.
Внесение основных веществ, снижающих кислотность почв, называется известкованием.
В качестве основных веществ используют главным образом соединения кальция, имеющие общее название «извести», поэтому этот метод химической мелиорации называют известкованием. Основным известкующим веществом является известняк (карбонат кальция СаСОэ). Используют как природный известняк, так и искусственный, входящий в состав отходов производства. При возможности (и необходимости) в известковании применяют гашеную известь Са(ОН)2; наиболее эффективна пушонка — рыхлый, легко рассеивающийся порошок; кипелку (оксид кальция СаО), ее использование требует большой осторожности, так как она жадно взаимодействует с водой, которая нагревается и вызывает ожоги при попадании на кожу. Известкующими веществами являются доломит СаС03 • MgC03 и жженая магнезия СаО • MgO
Известкующими реагентами являются отходы производства (сланцевая зола и др. ).
Сланцевая зола — отход сжигания горючих сланцев, содержит до 60% оксидов кальция и магния, а также соединения калия, серы, фосфора, микроэлементов, что делает эту смесь не только известкующей, но и удобряющей.
Дефекат — отход производства сахарозы, содержит карбонат кальция, гашеную известь и органические вещества.
Доменные и мартеновские шлаки, белитовая мука — отходы производства алюминия, которые содержат соединения кальция и магния.
Механизм известкования можно проиллюстрировать схемой:
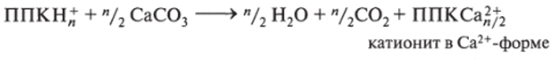
Для рационального проведения известкования необходимо исследовать параметры конкретной почвы, учитывать биологические особенности возделываемой культуры, технические характеристики известкующего реагента.
|
|
|


