 |
Физические свойства радона
|
|
|
|
Благородные газы – бесцветные одноатомные газы без цвета и запаха.
Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся: гелий ярко-жёлтым светом, потому что в его сравнительно простом спектре двойная жёлтая линия преобладает над всеми другими; неон огненно красным светом, так как самые яркие его линии лежат в красной части спектра.
Насыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
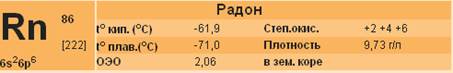
Радон светится в темноте, без нагревания испускает тепло, со временем образует новые элементы: один из них - газообразный, другой - твердое вещество. Он в 110 раз тяжелее водорода, в 55 раз тяжелее гелия, в 7 с лишним раз тяжелее воздуха. Один литр этого газа весит почти 10 г (точнее 9,9 г).
Радон - бесцветный газ, химически совершенно инертный. Радон лучше других инертных газов растворяется в воде (в 100 объемах воды растворяется до 50 объемов радона). При охлаждении до минус 62°С радон сгущается в жидкость, которая в 7 раз тяжелее воды (удельный вес жидкого радона почти равен удельному весу цинка). При минус 71°С радон "замерзает". Количество радона, выделяемое солями радия, очень мало, и чтобы получить 1 л радона, нужно иметь более 500 кг радия, в то время как на всем земном шаре в 1950 г. его было получено не более 700 г.
Радон - радиоактивный элемент. Испуская α-лучи, он превращается в гелий и твердый, тоже радиоактивный элемента который является одним из промежуточных продуктов в цепи радиоактивных превращений радия.
Естественно было ожидать, что столь химически инертные вещества, как инертные газы, не должны влиять и на живые организмы. Но это не так. Вдыхание высших инертных газов (конечно в смеси с кислородом) приводит человека в состояние, сходное с опьянением алкоголем. Наркотическое действие инертных газов обуславливается растворением в нервных тканях. Чем выше атомный вес инертного газа, тем больше его растворимость и тем сильнее его наркотическое действие.
|
|
|
ХИМИЧЕСКИЕ СВОЙСТВА РАДОНА
Ко времени открытия радона, типичного представителя благородных газов, существовало мнение, что элементы этой группы химически инертны и не способны образовывать истинные химические соединения. Известны были лишь клатраты, образование которых происходит за счет сил Ван-дер-Ваальса. К их числу относятся гидраты ксенона, криптона и аргона, которые получаются сжатием соответствующего газа над водой до давления, превышающего упругость диссоциации гидрата при данной температуре. Для получения аналогичных клатратов радона и обнаружения его по изменению упругости пара потребовалось бы практически недоступное количество этого элемента. Новый метод получения клатратных соединений благородных газов был предложен Б.А. Никитиным и состоял в изоморфном соосаждении молекулярного соединения радона с кристаллами специфического носителя. Изучая поведение радона при процессах соосаждения его с гидратами сернистого газа и сероводорода, Никитин показал, что существует гидрат радона, который изоморфно соосаждается с SO2Ч6H2O и H2SЧ6H2O. Масса радона в этих опытах составляла 10-11 г. Аналогично получены клатратные соединения радона с рядом органических соединений, например с толуолом и фенолом.
Исследования химии радона возможны лишь с субмикроколичествами этого элемента при использовании в качестве специфических носителей соединений ксенона. Следует, однако, учитывать, что между ксеноном и радоном находится 32 элемента (наряду с 5d-, 6s- и 6р-происходит заполнение 4f-орбит), что определяет большую металличность радона по сравнению с ксеноном.
|
|
|
Первое истинное соединение радона —дифторид радона — было получено в 1962 г. вскоре после синтеза первых фторидов ксенона. RnF2 образуется как при непосредственном взаимодействии газообразных радона и фтора при 400°С, так и при окислении его дифторидом криптона, ди- и тетрафторидами ксенона и некоторыми другими окислителями. Дифторид радона устойчив до 200° С и восстанавливается до элементарного радона водородом при 500°С и давлении H2, равном 20 МПа. Идентификация дифторида радона осуществлена путем изучения его сокристаллизации с фторидами и другими производными ксенона.
Ни с одним окислителей не получено соединение радона, где его степень окисления была бы выше +2. Причиной этого является большая устойчивость промежуточного продукта фторирования (RnF+X-) по сравнению с аналогичной формой ксенона. Это обусловлено большей ионностью связи в случае радонсодержащей частицы. Как показали дальнейшие исследования, преодолеть кинетический барьер реакций образования высших фторидов радона можно либо введением в реакционную систему дифторида никеля, обладающего наивысшей каталитической активностью в процессах фторирования ксенона, либо осуществлением реакции фторирования в присутствии бромида натрия. В последнем случае большая, чем у дифторида радона, фтордонорная способность фторида натрия позволяет конвертировать RnF+ в RnF2 в результате реакции: RnF+SbF6 + NaF = RnF2 + Na+SbF6. RnF2 фторируется с образованием высших фторидов, при гидролизе которых образуются высшие оксиды радона. Подтверждением образования соединений радона в высших валентных состояниях является эффективная сокристаллизация ксенатов и радонатов бария.
Долгое время не находили условий, при которых благородные газы могли бы вступать в химическое взаимодействие. Они не образовывали истинных химических соединений. Иными словами их валентность равнялась нулю. На этом основании было решено новую группу химических элементов считать нулевой. Малая химическая активность благородных газов объясняется жёсткой восьмиэлектронной конфигурацией внешнего электронного слоя. Поляризуемость атомов растёт с увеличением числа электронных слоёв. Следовательно, она должна увеличиваться при переходе от гелия к радону. В этом же направлении должна увеличиваться и реакционная способность благородных газов.
Так, уже в 1924 году высказывалась идея, что некоторые соединения тяжелых инертных газов (в частности, фториды и хлориды ксенона) термодинамически вполне стабильны и могут существовать при обычных условиях. Через девять лет эту идею поддержали и развили известные теоретики — Полинг и Оддо. Изучение электронной структуры оболочек криптона и ксенона с позиций квантовой механики привело к заключению, что эти газы в состоянии образовывать устойчивые соединения с фтором. Нашлись и экспериментаторы, решившие проверить гипотезу, но шло время, ставились опыты, а фторид ксенона не получался. В результате почти все работы в этой области были прекращены, и мнение об абсолютной инертности благородных газов утвердилось окончательно.
|
|
|
|
|
|


