 |
3. Материалы для самоподготовки к усвоению данной темы.
|
|
|
|
3. Материалы для самоподготовки к усвоению данной темы.
Вопросы для самоподготовки к занятию
1. Что такое концентрация? Какие способы ее выражения бывают?
2. Что такое массовая, объемная и молярная доля? Как их рассчитывают. Есть ли у них размерность?
3. Что такое молярная концентрация, молярная концентрация эквивалента? Как их рассчитывают, какова их размерность?
4. Что такое моляльная концентрация? Как ее рассчитывают, ее размерность?
5. Что такое титр и титр по определяемому веществу (двойной титр)? Как их рассчитывают, размерность?
6. Сущность титриметрического анализа. На каком законе основан этот метод и в каких случаях он применим?
7. На какие методы делится титриметрический анализ?
а) по типу реакции?
б) по способу титрования?
8. Какие объемные измерители бывают? Какие из них являются точными? Что такое бюретка, пипетка, мерная колба? Их применение.
9. Что такое ацидиметрия? Алкалиметрия? Какие вещества можно этими методами определять?
10. Приготовление рабочего раствора щелочи, кислоты. Почему их растворы нельзя приготовить по точной навеске?
11. Какие вещества называются первичными стандартами? Какие требования им предъявляются? Приведите примеры первичных стандартов для ацидиметрии и алкалиметрии.
12. Что такое стандартизация рабочего раствора? Что необходимо для этого?
13. Какие правила измерения объемов надо знать при пользовании бюреткой, пипеткой, мерной колбой?
14. Что такое индикаторы? Для чего их используют? Какие индикаторы называются кислотно-основными? Примеры.
15. Какие расчеты выполняются при стандартизации рабочих растворов? Как по результатам титрования можно найти содержание веществ в граммах и в процентах?
|
|
|
4. Вид занятия: лабораторное занятие
5. Продолжительность занятия: 3 академических часа
6. Оснащение рабочего места
6. 1. Дидактический материал: справочник физико-химических величин,
6. 2. ТСО: калькуляторы.
6. 3. Посуда и приборы: бюретка на 25 мл, пипетка на 10 мл, три конических колбы для титрования, мерная колба -на группу
6. 4. Объекты исследования: раствор соляной кислоты неизвестной концентрации (на группу)
6. 5. Реактивы: 0, 1н. раствор Na2CO3, индикатор-метилоранж (на группу)
7. Содержание занятия
7. 1 Образец билета входного контроля
1. В основе титриметрического анализа лежит закон:
а) Авогадро; б) эквивалентов;
в) сохранения массы веществ г) действующих масс
2. Метод нейтрализации основан на реакциях:
а) окисления-восстановления; б) осаждения;
в) кислотно-основного взаимодействия; г) комплексообразования
3. Для точного измерения объемов применяют:
а) мерную колбу; б) цилиндр;
в) пипетку, г) мензурку
4. Рабочий раствор щелочи готовят:
а) по точной навеске; б) но приблизительной навеске;
в) по точному объему; г) из стандарт-титра
5. Используется как первичный стандарт для стандартизации рабочего раствора соляной кислоты:
а) Н2С2О4× 2Н2О: б) NaOН; в) КВr; г) Na2CO3
7. 2 Узловые вопросы, необходимые для усвоения темы занятия
1. Растворы, классификация растворов
2. Способы выражения концентраций
3. Титриметрический анализ, его виды
4. Объемные измерители, правила измерения объемов
5. Титранты и стандарты. Требования к первичным стандартам
6. Конечная точка титрования, ее определение
|
|
|
7. Расчеты в титриметрии
7. 3 Самостоятельная работа обучающихся
7. 3. 1. Лабораторная работа
Задание 1. Приготовление 0, 1 моль/л раствора соляной кислоты из концентрированного раствора (ω =36, 5%; ρ =1, 19 г/мл).
Сначала оцените исходную молярную концентрацию раствора HCl. Затем у преподавателя получите задание – сколько необходимо приготовить 0, 1 моль/л раствора. Рассчитайте объем исходного раствора, необходимый для приготовления заданного объема его. Возьмите мерную колбу соответствующего объема и заполните наполовину дистиллированной водой. Осторожно, под вытяжным шкафом, пользуясь пипеткой с грушей, отмерьте рассчитанный объем концентрированной HCl и осторожно слейте в мерную колбу. Затем доведите объем раствора до метки, добавляя дистиллированную воду малыми порциями при перемешивании раствора. Приготовленный раствор слейте в склянку с крышкой и сделайте надпись: «0, 1 моль/л раствор HCl».
После выполнения работы вымойте всю использованную посуду и составьте протокол по выполненной работе.
Задание 2. Определение концентрации HCl по 0, 1н. раствору соды.
Реакция: 2HCl+Na2CO3 = 2NaCl+H2O+CO2.
Бюретку заполните 0, 1н. раствором соды. В коническую колбу с помощью пипетки и резиновой груши перенесите 10 мл раствора HCl, приготовленный вами ранее. Затем добавьте2 капли метилоранжа. При перемешивании приливайте из бюретки раствор соды к раствору кислоты до тех пор, пока раствор не станет из розового желтым. Запишите объем титранта V(Na2CO3). Титрование повторите трижды. Для расчета берите среднее арифметическое из трех опытов.
СН(HCl)=CH(Na2CO3)∙ V(Na2CO3)/V(HCl).
Сделайте вывод.
7. 3. 2. Задачи для самостоятельной работы
1. Способы выражения концентраций и их расчет
| Способ выражения концентрации | Определение | Расчетная формула | Размерность |
| Массовая доля (процентная концентрация по массе) | Содержание массы растворенного вещества в 100 массовых единицах его раствора | 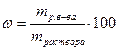
| безразмерная |
| Объемная доля (процентная концентрация по объему или градусы) | Содержание объема растворенного вещества в 100 объемных единицах его раствора | 
| - // - |
| Мольная доля (молярная доля) | Отношение числа молей растворенного вещества к сумме молей всех компонентов раствора | 
| - // - |
| Молярная концентрация | Число молей растворенного вещества в 1 л его раствора | 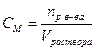
| моль/л |
| Моляльная концентрация | Число молей растворенного вещества в 1 кг растворителя | 
| моль/кг |
| Молярная концентрация эквивалента (нормальная концентрация) | Количество грамм-эквивалентов или условных частиц растворенного вещества в 1 литре раствора | 
| моль/л или г-экв/л |
| Титр | Масса растворенного вещества, содержащегося в 1 мл его раствора | 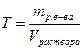
| г/мл |
| Титр по определяемому веществу (двойной титр) | Величина, показывающаяся, сколько грамм определяемого вещества соответствует (эквивалентно) 1 мл данного титранта | 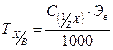
| г/мл |
|
|
|
|
|
|


