 |
7.3.2. Задачи для самостоятельной работы.
|
|
|
|
7. 3. 2. Задачи для самостоятельной работы.
1. Значение рН различных систем
| Среды организма | рН |
| Сыворотка крови | 7, 36-7, 44 |
| Чистый желудочный сок | 0, 9 |
| Сок поджелудочной железы | 7, 5-7, 8 |
| Желчь в протоках | 7, 4-8, 5 |
| Желчь в пузыре | 5, 4-6, 9 |
| Моча | 4, 8-7, 5 |
| Молоко | 6, 6-6, 9 |
| Дистиллированная вода, находящаяся в равновесии с воздухом | 5, 5 |
| Морская вода | 8, 0 |
| Свежий яичный белок | 8, 0 |
Значение рН, благоприятные для развития патогенных бактерий
| Вид бактерий | рН |
| Стафилококки | 7, 4 |
| Стрептококки | 7, 4-76 |
| Пневмококки | 7, 6-7, 8 |
| Менингококки | 7, 4-7, 6 |
| Гонококки | 7, 0-7, 4 |
2. Разбор типовых задач.
1. Вычислите рН фосфатного буфера, составленного из 100 мл 0, 1 М КН2РО4 и 50 мл 0, 15 М К2НРО4.
Решение: Расчет рН фосфатного буфера проводим по формуле:
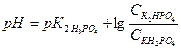
Значение  = 6, 8 (берем из справочника).
= 6, 8 (берем из справочника).
Так как концентрация вещества пропорциональна количеству вещества:
n = C× V,
то в формулу подставим количества вещества КН2РО4 и К2НРО4.

2. В каком мольном соотношении надо смешать аммиак и хлорид аммония, чтобы получить буферный раствор с рН = 9, 0, если рК  =4, 75?
=4, 75?
Решение: Расчет рН аммонийного буфера проводят по формуле:
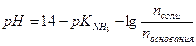
Подставляя значения рН и рК  получим:
получим:
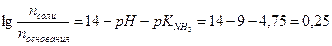
Тогда:
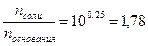
Следовательно, мольное соотношение NH4Cl к NH3 должно быть:
n  : n
: n  ® 1, 78: 1
® 1, 78: 1
3. Задачи для самостоятельной работы.
1. Какие пары образуют буферные растворы:
а) 50 мл 0, 1 М NaOH и 20 мл 0, 2 М СН3СООН
б) 50 мл 0, 1 М H2SO4 и 100 мл 0, 05 М NaOH
в) 50 мл 0, 1 М НС1 и 40 мл 0, 1 М CH3COONa
г) 20 мл 0, 1 М CH3COONa и 30 мл 0, 1 М СН3СООН
2. При определении альбумина по реакции с бромкрезоловым зеленым применяют ацетатный буфер. Уксусную кислоту объемом 50 мл смешивают с 13, 2 мл раствора гидроксида натрия (концентрация каждого раствора равна 1 моль/л) и объем доводят дистиллированной водой до 1 литра. Вычислите рН используемого раствора.
|
|
|
3. Рассчитайте молярное соотношение компонентов буферной системы, содержащей аммиак и хлорид аммония, имеющей рН=9, 8, если рК =4, 75.
4. Как изменится рН фосфатного буфера, содержащего 12 мл 0, 05 М гидрофосфата натрия и 8 мл 0, 05 М дигидрофосфата натрия, после добавления 2 мл 0, 05 М раствора NaOH?
5. Имеется 250 мл раствора аммиака с рН=11. Какую массу нитрата аммония следует растворить в этом растворе для получения буфера с рН=9, 0?
6. В качестве консерванта пищевых продуктов часто применяют бензоат натрия. Вычислите отношение концентраций бензоат-иона и бензойной кислоты: а) в желудочном содержимом (рН=0, 9), б) в содержимом кишечника (рН=7, 5). Принять, что рН биосред в норме и рК =4, 2.
7. Буферная емкость раствора по кислоте равна 40 ммоль/л. Вычислите, какой объем 0, 2 моль/л НС1 можно добавить к 100 мл этого раствора, чтобы сместить рН на 0, 4 единиц.
8. При исследованиях осмотической стойкости эритроцитов в клинической лаборатории применяют фосфатный буфер, который готовят следующим образом: безводный гидрофосфат натрия массой 27, 31 г, дигидрат дигидрофосфата натрия массой 4, 86 г и хлорид натрия массой 180 г растворяют в воде, после чего объем раствора доводят до 2 л. Вычислите рН такого буферного раствора. Объясните значение NaCl в этом растворе.
9. К 200 мл крови для изменения рН на 0, 36 надо добавить 26 мл 0, 01 М раствора НСl. Какова буферная емкость крови по кислоте?
10. Буферная емкость раствора по основанию равна 45 ммоль/л. Вычислите, какой объем раствора NaOH с концентрацией 0, 1 моль/л можно добавить к 250 мл этого буфера, чтобы сместить рН не более чем на 0, 3 единицы?
7. 4. Контроль усвоения темы занятия.
|
|
|
Задания выходного контроля.
1. Вычислите рН фосфатного буфера, состоящего из 100 мл 0, 1М NaH2РО4 и 100 мл 0, 3М Na2НРО4, рК =7, 21.
2. Вычислите рН ацетатного буферного раствора, содержащего 0, 5М соли и1М уксусной кислоты. рК=4, 76.
3. Вычислите рН аммиачного буферного раствора, содержащего 2М NH4OH (рК=4, 76) и 0, 3М NH4NO3.
4. Вычислите соотношение концентраций [ацетат натрия]: [уксусная кислота] в буферном растворе с рН=5, 8.
5. Рассчитайте емкость буферного раствора по кислоте, если при добавлении к 50 мл этого раствора 2 мл соляной кислоты с концентрацией 0, 8М рН изменился от 7, 3 до 7, 0.
|
|
|


