 |
2.5 Диапазон рабочих температур твердых электролитов
|
|
|
|
Современные твердые электролиты можно условно разделить на низко- (20-200°С), средне- (200-700°С) и высокотемпературные (700-1200°С) [47]. Температурные диапазоны даны весьма условно, так как в литературе нет единого мнения касательно границ рабочих температур твердых электролитов.
К первой группе можно отнести полимерные ионообменные (по H3O+) мембраны (нафион/гетерополикислота), Li3N, α -AgI, Na-β -Al2O3, Ag4RbI5. К среднетемпературным относят твердые электролиты NASICON, Li3Sc2(PO4)3, LaF3, CeO2 и Bi2O3, легированные оксидами редкоземельных элементов (РЗЭ), La1-xSrxGa1-yMgyO3-δ (LSGM) [46, 48].
Классическими представителями высокотемпературных твердых электролитов являются ионные проводники в системах MO2-MIO
и MO2-MIIO1, 5 (M = Zr4+, Hf4+, Th4+; MI = Ca2+, Sr2+, Ba2+; MII = Sc3+, Y3+, Ln3+), а также протонные проводники со структурой перовскита (например, перовскиты на основе цератов бария и стронция Ba(Sr)CeO3, перовскиты AZrO3, где A = Sr2+, Ba2+, Ca2+) [14]. На рисунке 4 представлена электропроводность некоторых вышеперечисленных ионных проводников в сравнении с жидкими электролитами, полупроводниками, металлами и диэлектриками [46].
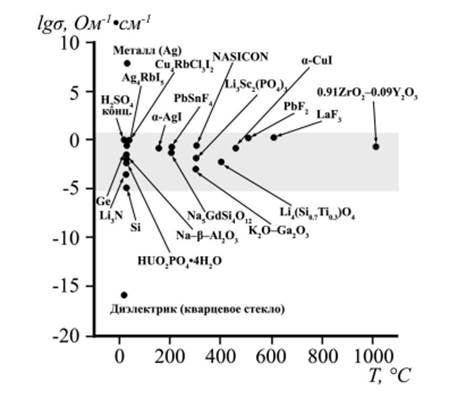
Рисунок 4 ‒ Электропроводность наиболее интересных ионных проводников в сравнении с жидкими электролитами, полупроводниками, металлами и диэлектриками. Выделенный сектор представляет важную с практической точки зрения область значений проводимости [46].
2. 6 Электролиты ТОТЭ и требования к ним
Электролит – важнейший компонент электрохимического источника тока, ответственный за ионный транспорт между электродами, разделяющий окислительную и восстановительную реакцию и блокирующий внутренний электронный перенос, вследствие чего электрический ток проходит через внешнюю схему, а не внутри ячейки. В основном в ТОТЭ используются кислород-ионные проводники (оксидные протон-проводящие электролиты активно исследуются, однако до сих пор не были коммерциализированы). Для обеспечения удовлетворительной работы ТОТЭ материал твёрдого электролита должен отвечать совокупности жёстких требований, которые сильно ограничивают выбор используемых соединений [5]:
|
|
|
1) высокая кислород-ионная проводимость при рабочей температуре элемента;
2) максимально низкая электронная проводимость (число переноса электронов не более 0, 01);
3) термодинамическая стабильность в широком диапазоне температур и парциального давления кислорода;
4) КТР, совместимый с КТР электродов;
5) высокая механическая прочность (от 200 – 400 МПа при комнатной температуре);
6) отсутствие активного химического взаимодействия с материалами электродов при температурах их формирования;
7) низкая стоимость самого материала и процесса изготовления функциональных слоёв.
Как следствие, из достаточно большого числа известных кислород-ионных проводников в качестве электролита ТОТЭ рассматриваются всего три семейства материалов: на основе ZrO2, CeO2 и LaGaO3. Некоторые твёрдоэлектролитные материалы перечислены в табл. 1 [6, 7]
Таблица 1. Проводимость и энергия активации некоторых твёрдых электролитов, применяемых в ТОТЭ

2. 7 Твердые электролиты на основе ZrO2
Чистый диоксид циркония может существовать в трех модификациях: моноклинной (m-ZrO2, пр. гр. P21/c, устойчива при T< 1100°C), тетрагональной (t-ZrO2, пр. гр. P42/nmc, устойчива в температурном диапазоне ~ 1100 ‒ 2400°C) и кубической (c-ZrO2, пр. гр. Fm3m устойчива при T > 2400°C) [49]. Однако, как отмечалось в [46] отклонение состава от стехиометрического, может приводить к варьированию температур фазовых переходов. С целью практического применения необходимо стабилизировать кубическую модификацию диоксида циркония введением двух- или трехвалентных катионов, например, оксидов щелочноземельных (ЩЗЭ) или редкоземельных элементов (РЗЭ), а также их комбинацией. Наиболее широкое применение для этих целей находят CaO, MgO, SrO, а также Y2O3, Sc2O3, La2O3, Sm2O3, Eu2O3, Gd2O3, Er2O3 [25, 26]. Благодаря такому гетеровалентному замещению помимо стабилизации кубической структуры ZrO2, происходит также образование кислородных вакансий, обуславливающих ионную проводимость в формирующихся аниондефицитных твердых растворах типа Zr1-xMxIO2-δ и Zr1-xMxIIO2-δ (MI = Ca2+, Sr2+, Ba2+; MII = Sc3+, Y3+, Ln3+). Замещение Zr4+ ионами металлов с меньшей степенью окисления с образованием кислородных вакансий в обозначениях Крёгера-Винка можно записать с помощью следующих квазихимических уравнений [50]:
|
|
|
MO → 𝑀 Zr′ ′ + 𝑂 𝑜 × + V𝑜 ••, (1)
M2O3 → 2𝑀 Zr′ + 3𝑂 𝑜 × + V𝑜 ••, (2)
где 𝑀 Zr′, 𝑀 Zr′ ′ – ион металла с меньшей валентностью на месте иона Zr4+ с отрицательным эффективным зарядом;
V𝑜 ••, – кислородная вакансия с положительным зарядом, компенсирующим заряд допанта;
3𝑂 𝑜 × – атом кислорода в регулярном узле с нейтральным зарядом.
Диоксид циркония, стабилизированный оксидом иттрия (YSZ), является одним из наиболее изученных твердых электролитов и находит широкое применение при создании электрохимических устройств. В качестве высокотемпературного электролита чаще всего используется ZrO2, содержащий 8 мол. % Y2O3 (8YSZ), так как в интервале температур 800- 1000º С он демонстрирует максимум ионной проводимости
(σ 1000º С = 1, 3·10-1 См/см, согласно данным [51]). В редких случаях содержание Y2O3 в твердом растворе на основе ZrO2 увеличивают до 10 мол. %, так как в этом случае электролит обладает долговременной стабильностью. Данный факт связан с тем, что граница стабильности кубической фазы в системе ZrO2‒ Y2O3 при 1000º С проходит вблизи концентрации Y2O3 10 мол. % (см. рисунок 2), в то время как YSZ при этой же температуре находится в области термодинамической устойчивости тетрагональной фазы, но может сохранять кубическую структуру вследствие медленной диффузии катионов [53]. Время термообработки и скорость охлаждения материалов в данной системе в значительной степени определяют микроструктуру и фазовый состав.
|
|
|
Согласно [52], если скорость охлаждения или длительность термообработки достаточны для достижения фазового равновесия, в кубической матрице твердого раствора в системе ZrO2‒ Y2O3 происходит реакция выделения включений тетрагональной фазы, в соответствии с диаграммой состояния. С целью увеличения ионной проводимости твердого электролита на основе диоксида циркония, в качестве допанта используют также оксид гадолиния. Фазовые диаграммы систем ZrO2‒ Y2O3 и ZrO2‒ Gd2O3 обладают значительным сходством (см. рисунок 5) по таким важным параметрам, как широкая область устойчивости кубических твердых растворов типа флюорита, узкая область существования тетрагональной фазы (до ~ 3 мол. % Gd2O3) [54]. Однако границы существования фаз у различных авторов не всегда совпадают. Так, S. Dutta и коллеги [55] изучали фазовый состав и электрофизические свойства твердых электролитов, полученных на основе системы ZrO2‒ Gd2O3 в диапазоне концентраций 1, 75-11 мол. % Gd2O3 при 1400°С. Авторским коллективом было установлено, что проводимость однофазных областей (тетрагональной – 2, 5-5, 5 мол. % Gd2O3, кубической – 9-11 мол. % Gd2O3) была выше по сравнению с областями существования смесей кубической и тетрагональной фаз (6-9 мол. % Gd2O3). Показано, что наивысшими значениями объемной и зернограничной проводимости обладали составы, содержащие 2, 5 и 4 мол. % Gd2O3. Схожие результаты наблюдали авторы [56] при исследовании электропроводности в тройной системе ZrO2‒ Y2O3‒ Gd2O3 (концентрация оксида иттрия была постоянна и составляла 3 мол. %, в то время как содержание оксида гадолиния изменяли в пределах 0-1 мол. %). Отмечалось, что повышенной объемной проводимостью по сравнению с ZrO2, содержащим 3 мол. % Y2O3 (3YSZ), характеризовались образцы, содержащие 0, 25 и 0, 50 ат. % Gd. При этом в качестве наиболее перспективного электролита для ТОТЭ был предложен состав с добавкой 0, 25 ат. % Gd, ввиду удачного сочетания как повышенной объемной, так и зернограничной проводимости (по сравнению с 3YSZ).
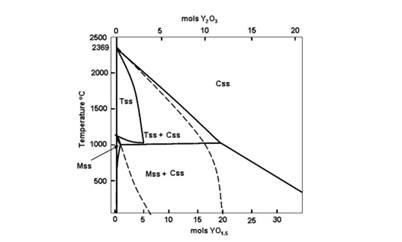
Рисунок 5 – Стабильная (сплошные линии) и метастабильная (пунктирные линии) фазовая диаграмма ZrO2‒ Y2O3 в области, богатой оксидом циркония.
|
|
|
Введение небольших количеств оксида магния (до 10 мол. %) в твердый раствор на основе диоксида циркония позволяет не только обеспечить ионную проводимость, но и повысить термическую стойкость получаемого твердого электролита (например, по сравнению с 3YSZ), что крайне важно при создании топливных элементов с высокими рабочими температурами. В настоящее время наиболее востребованными твердыми электролитами в системе ZrO2-MgO являются составы (см. рисунок 6), содержащие 8-10 мол. % MgO, представляющие собой смесь моноклинной фазы ZrO2 и оксида магния в диапазоне рабочих температур 800-1000°С [24]. Однако материалы на основе данной системы имеют недостаток – они уступают по ионной проводимости твердым растворам в системе ZrO2-Y2O3 [57]. С целью улучшения электрофизических свойств материалов на основе системы ZrO2-MgO E. Caproni и соавторы [57] вводили добавку 3YSZ, получая нанокомпозиты составов (ZrO2: 8 мол. % MgO)x – (YSZ)1-x (x = 0, 2; 0, 4; 0, 5; 0, 6; 0, 8). Было установлено, что ионная проводимость исследуемых материалов возрастала с увеличением содержания 3YSZ и при х = 0, 2 достигала максимума с сохранением термической стойкости полученных нанокомпозитов.

Рисунок 6 ‒ а) Фазовая диаграмма системы ZrO2‒ GdO1, 5 [31]; б) фазовая диаграмма системы ZrO2-MgO. Заштрихованная область обозначает диапазон составов твердых электролитов, обладающих наилучшими электрофизическими свойствами [57].
3. Характер проводимости твердых растворов на основе ZrO2
Изучению характера проводимости твердых растворов на основе ZrO2 посвящено большое количество работ. Приведем несколько примеров. Кинжери В. с сотрудниками [58], сравнивая электропроводность состава 0, 85ZrO2 + 0, 15CaO с ее значениями, рассчитанными по величине коэффициента диффузии кислорода, пришли к заключению, что электропроводность имеет ионный характер, а число переноса ионов кислорода равно единице. Было отмечено также, что ионная проводимость не изменяет своей величины при пониженных парциальных давлениях кислорода в газовой фазе. Неуймин А. Д. и Пальгуев С. Ф. [58] определили практически чисто ионный характер проводимости твердых растворов ZrO2 + Y2O3 в широком интервале составов.
В то же время для ряда составов систем ZrO2 – La2O3 и ZrO2 – Na2O3 они зафиксировали и некоторую долю электронной проводимости. Но, как видно из результатов этой работы, образцы со смешанным характером проводимости не были однофазными, то есть электронная проводимость в данном случае не была обусловлена проводимостью кубической фазы. Чисто ионный характер проводимости в температурной области 873 К - 1273 К имеет твердый раствор 0, 88ZrO2 + 0, 12 Sc2O3. Очевидно, что при этих температурах образцы, содержащие 9-13 мол. % также являются ионными проводниками.
|
|
|
Величина ионной проводимости твердых растворов на основе ZrO2 зависит от величины радиуса катиона примесного оксида [59]. Так, в ряду ZrO2 + СаO, ZrO2 + Y2O3, ZrO2 + Sc2O3 при одинаковом содержании стабилизирующего оксида величина его катионного радиуса уменьшается. В этом же направлении происходит уменьшение параметра кристаллических решеток твердых растворов и увеличение их электропроводности. Исследование ряда твердых растворов ZrO2 + оксид РЗЭ [61] показало, что зависимость электропроводности от радиуса катиона оксида-добавки имеет линейный характер, и, следовательно, при любой комбинации оксидов РЗЭ она будет соответствовать среднему радиусу катионов. Поэтому, как считают авторы, невозможно получить электропроводность выше той, которая наблюдается в системе ZrO2 - Sc2O3. Исследование этой зависимости в системе Sc2O3 - CaO - MgO показало, что электропроводность устойчивых твердых растворов повышается при уменьшении среднего значения ионных радиусов кальция и магния, но при этом она все же остается более низкой, чем электропроводность составов системы ZrO2 – Sc2O3 имеющих очень близкие значения ионного радиуса [62].
3. 1 Электропроводность в бинарных системах на основе ZrO2
Электропроводность в бинарных системах на основе ZrO2 достигает максимума при содержаниях примесного оксида, соответствующих, как показано в ряде работ [60, 61], положению нижней границы существования кубических твердых растворов. С дальнейшим увеличением содержания стабилизирующего оксида концентрация кислородных вакансий линейно возрастает, однако величина ионной проводимости при этом начинает уменьшаться. Существует мнение, что это вызвано уменьшением подвижности ионов кислорода. Так, в системе ZrO2- СаO в результате замены ионов циркония в узлах катионной подрешетки более крупными ионами кальция перескок иона кислорода в соседнюю вакансию будет затруднен. Чем больше будет введено примесного оксида, тем чаще иону кислорода придется проходить мимо одного, а то и двух ионов кальция [22]. Как отмечено в ряде работ [63-65], между дефектами с различными зарядами при большой их концентрации существует взаимодействие кулоновского характера, в результате которого они могут объединяться.
В структуре твердых растворов на основе ZrO2 вероятно возникновение неоднородностей в виде микродоменов, отличающихся по своему составу от основной кубической матрицы. Согласно [66], микродомены в твердых растворах ZrO2 + СаО и HfO2 + CaO имеют размеры приблизительно 3 нм. и составы CaZr4O9, CaHf4O9. Они располагаются когерентно в нескольких определенных направлениях внутри кубической матрицы. Отмечается, что микродомены не образуют заметной границы с основной кубической фазой, тем не менее они оказывают заметное влияние на проводимость.
Как показано в ряде исследований, электропроводность твердых растворов на основе ZrO2 при очень малых и больших концентрациях кислорода в газовой фазе приобретает смешанный характер. Так, по данным Шмальцрида [76], твердый электролит (ZrO)0, 85(CaO)0, 15 при температуре 1073 К и PO2 = 10-25 Па становится электропроводящим. Для оценки электронной проводимости Шмальцрид предложил использовать электронный параметр переноса ре – величину, соответствующую такому парциальному давлению кислорода, при котором числа переноса ионов и электронов равны между собой. Паттерсон с соавторами [68] показали, что суммарная проводимость электролита (ZrO)0, 85(CaO)0, 15 возрастает при уменьшении PO2. При этом получили такие значения ре: 10-30 Па (973 К), 10-25 Па (1173 К), 10-22 Па
(1273 К). Появление электронной составляющей проводимости отмечалось и для твердых растворов ZrO2 + Y2O3 [69]. По данным [70], в электролите (ZrO)0, 90(CaO)0, 10 при температуре 1273 К PO2 = 10-21 Па электронная проводимость составляет 10% от величины суммарной проводимости.
3. 2 Термостойкость ZrO2
Твердые растворы на основе ZrO2 в процессе длительных выдержек при рабочих температурах начинают распадаться в результате процесса дестабилизации [71, 70]. Наиболее активно этот процесс происходит в системе ZrO2 - MgO. Сравнительно хорошую устойчивость имеют твердые растворы ZrO2 + Y2O3 данным [72] они не распадаются во время длительных выдержек при температурах 1073 - 1873 К. При длительных выдержках наблюдается также возрастание электрического сопротивления твердых растворов. Этот процесс, получивший название " старения", в системе
ZrO2 - СаО происходит наиболее заметно при больших содержаниях СаО
(20 мол. %). Авторы работ [73] объясняют старение более упорядоченным распределением катионов и анионов в кристаллической решетке, формированием так называемой " сверхструктуры". Процесс старения отмечается и для такого " оптимального" по составу твердого электролита, как (ZrO)0, 91(CaO)0, 09 Исследованию стабильности структурных электрических характеристик твердых растворов на основе ZrO2 уделяется большое внимание и в настоящее время [80].
Стабилизированный ZrO2имеет низкую термостойкость, что обусловлено его низкой теплопроводностью и высоким коэффициентом термического расширения. В огнеупорной и керамической практике для повышения термостойкости этого материала искусственно создают нем структуру микротрещин [74-79]. Микротрещиноватость обеспечивает условие для более свободного расширения отдельных зерен нагревании и препятствует образованию более крупных трещин. Для этого в шихту вводят добавки, отличающиеся от основного материала коэффициентом линейного расширения. Значительный эффект увеличения термостойкости дает добавление к основной массе стабилизированного ZrO2 некоторого количества его моноклинной формы.
3. 3 Влияние примесей на физико-химические свойства твердых растворов на основе ZrO2
Различное влияние на термостойкость ZrO2 оказывают примеси. Так, по данным [81] TiO2 (до 1, 85 масс, %) не изменяет термостойкость, Fe2O3 (до 0, 84 масс, %) ухудшает, а Al2O3, несколько улучшает ее.
Примеси оказывают влияние на многие физико-химические свойства твёрдых растворов на основе ZrO2, Fe2O3, TiO2 Al2O3 повышают механическую прочность керамики при комнатной температуре [81]. Небольшие количества Fe2O3 заметно понижают температуру спекания керамики и формирования кубической структуры [81-83]. Такое же действие оказывают примеси Al2O3 и Bi2O3 причем последний заметно уменьшает электропроводность [83]. С другой стороны, TiO2, Al2O3, SiO2 взаимодействуют с оксидом-стабилизатором, способствуя тем самым процессу дестабилизации ZrO2 [83, 85]. Небольшие примеси переходных металлов увеличивают долю электронной составляющей проводимости твердых электролитов газовых средах с низкой концентрацией кислорода [84]. Следует учитывать и факт взаимодействия, стабилизированного ZrO2 с водой, что может привести при высоких температурах к возникновению протонной проводимости.
Рассмотрим несколько примеров исследований многокомпонентных систем на основе ZrO2. В системах ZrO2 + СаO + Fe2O3 и ZrO2 + Fe2O3 + Y2O3 [86, 87] железо входит в состав образующихся в процессе обжига трёхкомпонентных твердых растворов с кубической структурой типа флюорита. Так, в смеси 0, 90ZrO2 + 0, 10Y2O3 растворяется до 15 мол. % Fe2O3. Ионы железа, по мнению авторов работ, могут размещаться в узлах и в междоузлиях кристаллической решетки. Введение до 3-5 мол. % Fe2O3 приводит к заметному уменьшению электропроводности и не оказывает существенного влияния на ионный характер проводимости в атмосферах кислорода и воздуха [85].
Электропроводность твердых растворов ZrO2 + Fe2O3 + Y2O3 сохраняет чисто ионный характер при содержании Fe2O3 до10 мол. %, но при увеличении его содержания принимает смешанный характер. Как видно, наличие растворимости Fe2O3в кубических твёрдых растворах отмечается в ряде работ. В то же время утверждается, что Fe2O3 не образует твердых растворов с моноклинным ZrO2 [88].
Исследование многокомпонентных систем приводят также с целью подбора электролитов, имеющих лучшие характеристики чем бинарные твердые электролиты. Так, например, твердые электролиты ZrO2 + СаO + Y2O3 благодаря более оптимальному среднему радиусу катионов примесных оксидов, имеют более высокую электропроводность и стабильность чем твердые электролиты системы ZrO2 + СаO [88-89]. Электролит состава
ZrO2 + Y2O3 + MgO, по утверждению автора, при более низкой стоимости не теряет высоких электрических свойств составов ZrO2 - Y2O3. С этой целью исследуют более сложные системы, как, например, ZrO2 - Y2O3 – CaO - MgO [90]. В данном случае стремились заменить часть Y2O3 более дешевой смесью СаO + MgO, средний катионный радиус которой с целью сохранения хороших электрических и структурных характеристик подбирался близким к величине ионного радиуса иттрия.
Исследования систем ZrO2 –TiO2– Y2O3, и ZrO2 –CeO2– Y2O3, [91] показали, что замена части ZrO2 на TiO2 или CeO2 структуры и величины катионных радиусов которых заметно отличаются, приводит к одинаковому результату: ионная проводимость образующихся при этом кубических твердых растворов уменьшается по сравнению с бинарными составами
ZrO2 – Y2O3. В данном случае, как видно, не наблюдается четкой однозначной зависимости величины электропроводности от размера среднего катионного радиуса базисных (ZrO2, TiO2, CeO2) и примесного оксидов.
4. Получение водорода методом электролиза
По-видимому, в ближайшем будущем методы получения водорода с использованием углеродного сырья будут основными. Однако сырьевые и экологические ограничения процесса паровой конверсии метана стимулируют разработку процессов производства водорода из воды. Среди способов получения водорода из воды наибольший интерес в контексте атомно-водородной энергетики представляют электролиз, термохимические и термоэлектрохимические циклы.
Впервые электролитическое разложение воды на кислород и водород осуществлено в 1800 г., а промышленное освоение этого метода началось с 1888 г., когда стали доступны генераторы постоянного тока. Электролиз воды является наиболее перспективной технологией получения водорода в будущем, хотя в настоящее время из-за высокой стоимости доля этого метода в мировом производстве водорода не превышает 5%. Наиболее привлекательными особенностями электролизной технологии являются экологическая чистота (разумеется, при условии, что производство первичной энергии не сопряжено с загрязнением окружающей среды), возможность создания установок с широким диапазоном производительности (от нескольких литров до сотен м3 водорода в час), простота эксплуатации и удобство в работе, высокая чистота производимого водорода и наличие ценного побочного продукта — газообразного кислорода. Метод нашел широкое применение в ряде стран, обладающих значительными ресурсами дешевой гидроэнергетики. Наиболее крупные электрохимические комплексы находятся в Канаде, Индии, Норвегии, Египте.
Из различных методов разложения воды (электрохимический, термический, термохимический, биохимический, фотохимический и др. ) технически наиболее разработан электролитический метод, который позволяет производить водород с полезным использованием затрачиваемой электрической энергии примерно 70%. При дальнейшем усовершенствовании процесса теоретически возможно увеличение этого показателя до 80%, а при высокотемпературном электролизе и до 80–90%.
В настоящее время существуют три способа реализации электролизной технологии производства водорода, отличающиеся типом используемого электролита и условиями проведения электролиза.
Таблица 5. – Способы реализации электролизной технологии производства водорода. 
4. 1 Щелочной электролиз
Щелочной электролиз — процесс прохождения электрического тока через раствор электролита от анода к катоду, вследствие чего на них соответственно образуются газы водород и кислород. В качестве электролита в воднощелочном электролизере применяются водные растворы KOH и NaOH.
Концентрация электролита в растворе, как правило составляет до 40% масс, чтобы обеспечить максимум электропроводности при рабочих температурах до 90 °С. На рисунке 7 представлена принципиальная схема водно-щелочной ячейки электролизера.
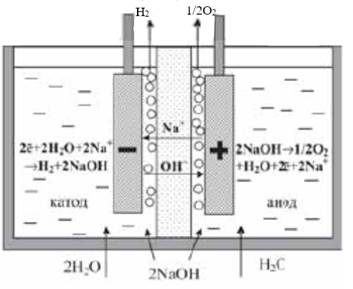
Рисунок 7. – Принципиальная схема водно-щелочной ячейки электролизера.
Особенность процесса щелочного электролиза — возможность работать в широких пределах нагрузки (начиная с 20% от номинальной мощности). Основными производителями являются: Stuart IMET, The Electrolyser Corporation Ltd, Norsk Hydro, DeNora, НПО «Уралхиммаш» и др.
В качестве электродов используются стальные сетки, покрытые иногда слоем пористого никеля, получаемого выщелачиванием цинка из
сплава Ni-Zn. Пористую диафрагму, разделяющую катодное и анодное пространства, изготавливают, как правило, из асбеста. Следует отметить, что наличие пористой диафрагмы создает определенные проблемы с безопасной эксплуатацией электролизеров, особенно при повышенных давлениях, за счет возможного смешения получаемых газов, а также снижает их чистоту.
Основными достоинствами электролизеров данного типа являются небольшая стоимость материалов для электродов и диафрагм, а также достаточно хорошо отработанная технология их эксплуатации и производства. Несмотря на данные преимущества, качество получаемого водорода остается достаточно посредственным за счет содержания примеси кислорода и водяного пара со щелочью. Поэтому, непосредственно, необходима дополнительная очистка.
Работа водно-щелочных электролизеров осуществляется при следующих параметрах: плотность тока составляет 0, 2 – 0, 3 А/см2, энергозатраты для производства водорода приблизительно составляют
4, 1 – 4, 5 кВт*ч/нм3. В основном повышение энергозатрат связано с увеличением омических потерь в верхней части электролизных ячеек из-за выделяющихся пузырьков с газом, а также с экранированием поверхности электродов (рис. 7). В России данный тип электролизеров с асбестовыми диафрагмами выпускаются на предприятии Уралхиммаш и обладают производительностью 4 – 250 нм3/ч при рабочем давлении 1Мпа [94].
4. 2 Электролиз с твердым полимерным электролитом (ТПЭ)
К исследованиям, направленным на усовершенствование традиционного процесса электролиза воды и повышения его экономичности, можно отнести разработку электролизёров с твердо-полимерным электролитом (ТПЭ). Данный метод производства водорода исторически связан с появлением перфторированной ионообменной мембраны «Нафион» фирмы DuPont. Первые электролизёры с ТПЭ были созданы в 1966 г. Компанией General Electric. Такие изделия предназначались для специальных целей (космические корабли, подводные лодки и т. п. ), а также для нужд гражданской индустрии.
В настоящее время областями применения электролизёров с ТПЭ, помимо использования произведенных ими газов в топливных элементах, являются: аналитическое приборостроение (оборудование для газовой хроматографии, обеспечение водородом лабораторий), системы коррекции водно-химического режима атомных реакторов, водородная сварка, производство особо чистых веществ для электронной промышленности и т. п. Водород также широко используется в различных химических технологических процессах, например, аммиака, при гидрировании органических соединений. При этом производимый кислород, помимо его использования для дыхания (например, в медицине), может быть применен в некоторых областях промышленной энергетики, таких как различные процессы горения, производство полупроводников, выплавка стекла, обработка твердых бытовых отходов и сточных вод, а также газификация угля. Необходимо отметить, что при некоторых условиях, помимо производства водорода и кислорода, в процессе электролиза воды с ТПЭ может выделяться озон. Схема процесса электролиза воды в твердом полимерном электролите представлена на рисунке 8.
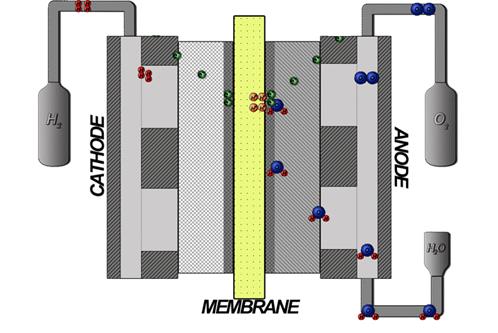
Рисунок 8. – Схема процесса электролиза воды в твердом полимерном электролите
Процесс электролиза воды в твердом полимерном электролите осуществляется следующим образом. Дистиллированная вода подается на в анодное пространство электролизера и проникает через поры анода к границе раздела электрод – мембрана. На этой границе происходит электроокисление воды с выделением кислорода по следующей реакции:
2H2O → O2 + 4H+ + 4e-
Кислород удаляется из реакционной зоны. Протоны движутся через мембрану к катоду, где происходит их восстановление с выделением газообразного водорода:
2H+ +2e- → H2
Проще говоря, протоны проводятся от анода к катоду. Протон, прошедший через протонообменную мембрану к катоду, получает от катода электрон и становится атомом водорода. Моментально два атома водорода соединяются между собой в молекулу водорода, которая затем растворяется в воде. Непроницаемость мембраны для кислорода препятствует проникновению его в катодное пространство и образованию взрывоопасной смеси кислорода и водорода.
Протекание катодной и анодной реакций стимулируется введением на границы раздела электроды/ТПЭ катализаторов - мелкодисперсных платины и оксида иридия (IV), что делает процесс электролиза более эффективным.
Одновременно протонообменная мембрана является изолятором для электронов и барьером для реагентов, например, для кислорода, водорода, озона, хлора. Основная функция протонообменной мембраны в
электродно-мембранной ячейке - разделение реагентов и перенос протонов через мембрану при блокировании прямого пути электронов через мембрану.
ТПЭ электролизёры в 5–7 раз дороже водно-щелочных с аналогичными
характеристиками, но при этом экологически чистые, имеют значительно меньшие массогабаритные характеристики и энергозатраты, повышенный уровень безопасности, возможность работы в нестационарных режимах, простое обслуживание, и в дополнение ко всему, можно получить компримированные газы (до 30 атм. и более) непосредственно в электролизёре.
Важной особенностью систем электролиза воды с ТПЭ является то, что чистота производимого водорода (а также кислорода) соответствует качеству газов, необходимых для использования в топливных элементах с ТПЭ, которые сегодня начинают внедряться на транспорте и в децентрализованной энергетике (например, чистота водорода, полученного электролизом с ТПЭ, составляет не менее 99, 98%). Но и сами электролизные системы на основе ТПЭ предъявляют жесткие требования к чистоте подаваемой воды.
В России одну из лидирующих позиций в разработке и производстве систем электролиза воды с ТПЭ занимает ИВЭПТ ФГУ РНЦ «Курчатовский институт». За более чем 20 лет работы в этом направлении созданы электролизёры различной производительности с рабочим давлением до 30 атм. Так, например, разработаны электролизёры с производительностью по водороду до 100 м3/ч, работающие под давлением до 30 атм. К настоящему моменту в ФГУ РНЦ «Курчатовский институт» накоплен значительный опыт по проектированию и изготовлению опытных и мелкосерийных образцов, имеются конструкторские и технологические разработки для изготовления элементов конструкции (мембранно-электродных блоков, коллекторов тока, биполярных пластин, уплотнительных элементов и т. д. ) [94].
Также довольно хорошие характеристики имеет электролизёр с катодным катализатором на основе Pd (включая Pd на углеродном носителе).
Рабочие характеристики электролизёров:
1. Энергозатраты 3, 9–4, 1 кВт ·ч/м3 водорода при i = 1 А/см2 и
t = 90 °C и напряжении на ячейке U = 1, 65–1, 72 В;
2. Чистота водорода> 99, 98%;
3. Выход по току для водорода> 98% при 1 А/см2;
4. Рабочее давление до 30 атм. (ведется разработка электролизёров, работающих под давлением до 50 атм. );
5. Расход благородных металлов 0, 3–1, 0 мг/см3 на катоде и 1, 5–2, 0 мг/см3 на аноде;
6. Ресурс работы до 10000 ч.
Основные компоненты ячейки электролизера воды с ТПЭ представлены на рисунке 9: протонообменная мембрана (1), на которую наносятся электрокаталитические слои (2), пористый коллектор тока (3) (обычно используются пластины из спеченного титанового порошка толщиной около 1 мм) и титановые биполярный пластины (4) для разделения ячеек в батарее
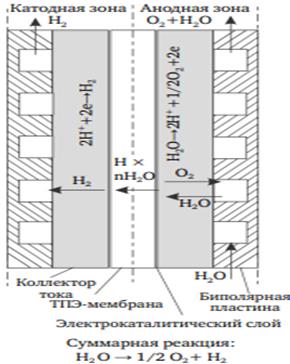

Рисунок 9 - Схематичное изображение поперечного сечения ячейки
электролизера воды с ТПЭ. 1 – твердый полимерный электролита; 2 –
электрокатлитические слои (a – анодный, c – катодный); 3 – пористый коллектор тока (a – анодный, c – катодный); 4 – биполярные пластины (a – анодная сторона, c – катодная сторона)
Энергетическая эффективность процесса электролиза определяется рядом процессов, таких как транспорт воды (реагента) и газов (продуктов реакции) к и от зоны реакции, электронный и протонный ток, теплоперенос. В ячейках с ТПЭ электрический ток течет от одной биполярной пластины (4a на рисунке 9) к другой (4c на рисунке 9). В то же самое время, массоперенос происходит через пористый коллектор тока (3a и 3c на рисунке 9). В частности, газы, образующиеся во время электрохимического разделения воды (водород и кислород), транспортируются из каталитических слоев в собирающиеся каналы, сделанные в биполярных пластинах. С точки зрения качества, коллектор тока большой пористости будет способствовать более легкому отводу газов, но также это увеличит омическое сопротивление пластин и внесет дополнительные омические потери в точке контакта коллектора тока с каталитическим слоем (с одной стороны) и коллектора тока с собирающим каналом (с другой стороны). Поэтому, необходима оптимизация структуры пор как по общей пористости, так и по распределению размеров пор. Ряд исследований показывают, что наиболее оптимальный размер сферических титановых частиц (из которых изготавливаются титановые коллекторы тока) должен составлять 50-75 мкм [25]
Как уже отмечалось, существенным является возможность проведения электролиза воды с ТПЭ при повышенных давлениях. Исследования показали, что при проведении процесса электролиза при повышенном давлении (до 30 атм. ) наблюдается улучшение вольтамперной характеристики при рабочих плотностях тока по сравнению с электролизом при атмосферном давлении. Это обусловлено, в первую очередь, снижением анодного перенапряжения. Так, при плотности тока 2 А/см2 на видимую поверхность напряжение электролиза уменьшается на 70–80 мВ. Кроме того, повышенное давление позволяет проводить электролиз при температуре выше 100 °C, тем самым снижая энергозатраты за счет уменьшения сопротивления мембраны и снижения перенапряжения. В частности, при температуре 120 °C и давлении 25 атм. при плотности тока 1 А/см2 видимой поверхности напряжение на ячейке составило 1, 64 В.
Теоретический анализ позволяет предполагать, что увеличение давления приводит к уменьшению объема пузырьков газа, выделяющегося в процессе электролиза, что, в свою очередь, способствует улучшению транспорта воды, уменьшению омических потерь в каталитическом слое и улучшению электрического контакта между каталитическим слоем и коллектором тока. Несмотря на большой объем исследований и разработок в области электролизёров с ТПЭ, высокая стоимость мембраны (около 200 долл. на 1 м3/ч водорода при 1 А/см2), электрокатализатор с применением драгметаллов (Pt, Ir, Ru), высокие требования к чистоте воды и конструкционных материалов (в основном, Ti) приводят к относительно высокой стоимости такого типа электролизёров. С другой стороны, стоимость производимого методом электролиза водорода обычно приблизительно на 70% состоит из стоимости электричества, поэтому сни
|
|
|


