 |
В) молярную долю кислоты в растворе.
|
|
|
|
УРОВЕНЬ В
1. Определить количество моль воды в формуле кристаллогидрата Na2CO3·nH2O, если в результате прокаливания его масса изменилась от 1,43 до 0,53 г. Определить объем выделившейся парообразной воды при 200оС и давлении 98,2 кПа.
Дано:
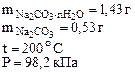
| РЕШЕНИЕ:
При прокаливании кристаллогидрата протекает реакция:
Na2CO3·nH2O  Na2CO3 +nH2O↑(1.1)
Находим массу воды ( Na2CO3 +nH2O↑(1.1)
Находим массу воды (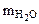 ), выделившейся при разложении кристаллогидрата: ), выделившейся при разложении кристаллогидрата:
|

|
 = 1,43 - 0,53 = 0,9 г
= 1,43 - 0,53 = 0,9 г
Расчет n ведем по уравнению реакции (1.1)
 -
-  106 г/моль - n18 г/моль
106 г/моль - n18 г/моль
 -
-  0,53 г - 0,9 г
0,53 г - 0,9 г
где 

n =  =
= 
Формула кристаллогидрата Na2CO3·10H2O
Рассчитываем объем выделившейся газообразной воды при
Т = 273 + 200 = 473 К и Р = 98,2 кПа по уравнению Менделеева-Клапейрона

где Р – Па, V – м3, m – кг, М 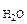 – кг/моль, R – 8,314 Дж/моль·К,
– кг/моль, R – 8,314 Дж/моль·К,
Т – К.
Откуда 
Ответ: формула кристаллогидрата: Na2CO3·10Н2О; 
2. Определить состав смеси (% масс.), содержащей карбонат магния (15 г) и оксид магния. Если после прокаливания смеси, полученный продукт вступил в реакцию с ортофосфорной кислотой и образовалось 80 г ортофосфата магния. Составить уравнения реакций.
Дано:
MgO и MgCO3
m  = 15 г
m = 15 г
m  = 80 г = 80 г
| РЕШЕНИЕ:
  + + 
 мас. мас.
 мас. мас.
|
ω  -? ω -? ω  -? -?
|
При прокаливании смеси протекает реакция
MgCO3  MgO + CO2
MgO + CO2
Тогда по этому уравнению
М  -
-  84,3 г/моль - 40,3 г /моль
84,3 г/моль - 40,3 г /моль
m  -
- 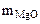 (из MgCO3) 15 г -
(из MgCO3) 15 г - 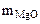 (из MgCO3)
(из MgCO3)
где  = 24,3 + 16 = 40,3 г/моль
= 24,3 + 16 = 40,3 г/моль
М  = 24,3 + 12 + 16·3 = 84,3 г/моль
= 24,3 + 12 + 16·3 = 84,3 г/моль
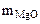 (из MgCO3) =
(из MgCO3) =  =
=  = 7,17 г
= 7,17 г
После прокаливания смесь состоит только из MgО

При взаимодействии продукта, полученного после прокаливания с ортофосфорной кислотой, протекает реакция
3MgO(общ.) + 2H3PO4 = Mg3(PO4)2 + 3H2O
3МMgО ________ М 
 mMgO(общ) 80 г
mMgO(общ) 80 г
тогда
 3∙ 40,3г/моль 262,9 г/моль
3∙ 40,3г/моль 262,9 г/моль
 mMgO(общ) 80 г
mMgO(общ) 80 г
где М  = 40,3 г/моль, М
= 40,3 г/моль, М  = 262,9 г/моль
= 262,9 г/моль
откуда mMgO(общ) =  г
г
тогда
mMgO(исх) = mMgO(общ) – mMgO (из MgCO 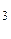 ) = 36,79 г – 7,17 г = 29,62 г
) = 36,79 г – 7,17 г = 29,62 г
Таким образом
|
|
|
mсмеси = mMgO(исх) +  = 29,62 г + 15 г = 44,62 г
= 29,62 г + 15 г = 44,62 г
Состав исходной смеси
ω  =
=  мас.
мас.
ω  = 100 – 66,38 = 33,62% масс.
= 100 – 66,38 = 33,62% масс.
3. При взаимодействии 1,8 г технического карбоната кальция (мела) с HCl выделилось 400 см3 CO2, собранного над водным раствором NaHCO3 и измеренного при температуре 288 К и давлении 730 мм рт.ст. Давление паров воды при 288 К равно 12,79 мм рт.ст. Определить содержание СаСО3 в техническом карбонате кальция в процентах.
Дано:

 
| РЕШЕНИЕ:
 Так как, примеси, содержащиеся в техническом СаСО3 не взаимодействуют с HCl с образованием CO2, то массу чистого карбоната кальция (
Так как, примеси, содержащиеся в техническом СаСО3 не взаимодействуют с HCl с образованием CO2, то массу чистого карбоната кальция ( )
определяем по уравнению реакции (1.4): )
определяем по уравнению реакции (1.4):
|
СаСО3 +2HCl=CaCl2 + H2O+CO2↑ (1.4)

 22400 cм3 (н.у.)
22400 cм3 (н.у.)



Находим 
 100 г/моль 22400 см3
100 г/моль 22400 см3



где 
откуда 
 (1.5)
(1.5)
где  - объем выделившегося СО2, приведенный к нормальным условиям.
- объем выделившегося СО2, приведенный к нормальным условиям.
 Для определения
Для определения  воспользуемся объединенным газовым законом:
воспользуемся объединенным газовым законом:
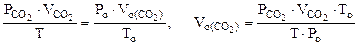
где 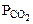 - парциальное давление СО2, так как СО2 собран над водным раствором NaHCO3, то
- парциальное давление СО2, так как СО2 собран над водным раствором NaHCO3, то
 =
= 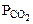 +
+  , тогда
, тогда
 мм рт.ст.
мм рт.ст. 
Тo = 273 К,
Рo = 760 мм рт. ст.,
тогда  =
= 
Определяем массу чистого СаСО3 по формуле (1.5):
 =
=  , тогда
, тогда

Ответ: содержание СаСО3 в меле 88,89%.
2. ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
УРОВЕНЬ В
1. При растворении 16,25 г двухвалентного металла в кислоте выделилось 6,52 л водорода, собранного над водой и измеренного при температуре 298К и давлении 730 мм рт. ст. Определить молярную массу эквивалента металла и назвать металл. Давление паров воды при температуре 298К равно 23,76 мм рт. ст.

| РЕШЕНИЕ:
По закону эквивалентов
 = = 
 Мэк(Ме) =
Мэк(Ме) =  = =
 = 11,2 л/моль = 11,2 л/моль
|
По объединенному уравнению газового состояния

где: То = 273 К, Ро = 760 мм рт.ст.
Робщ =  +
+  ;
;  = Робщ -
= Робщ - 

определяем 

 = 5,55 л
= 5,55 л
Мэк(Ме) =  =32,79 г/моль
=32,79 г/моль
Мэк(Ме) =  , г/моль, где В – валентность металла
, г/моль, где В – валентность металла
ММе = Мэк(Ме) ∙ В = 32,79 ∙ 2 = 65,58 г/моль, что соответствует молекулярной массе атома цинка.
Ответ: Мэк(Zn) = 32,79 г/моль, металл – Zn
|
|
|
2. При окислении металла израсходовано 3,79 л кислорода, измеренного при 293 К и давлении 740 мм рт.ст. Образовалось 39,43 г оксида. Определить молярные массы эквивалентов металла и оксида. Назвать металл.
 
| РЕШЕНИЕ:
По закону эквивалентов
nэк (окс) = nэк(О2)
 Мэк(Окс) =
Мэк(Окс) = 
 л/моль л/моль
|
По объединенному уравнению газового состояния

где: ТО = 273 К, РО = 760 мм рт.ст.
определяем 
 =
=  = 3,44 л.
= 3,44 л.
Мэк(Окс) =  64,2 г/моль
64,2 г/моль
Мэк(Окс) = Мэк(Ме) + Мэк(О)
Мэк(Ме) = Мэк(Окс) - Мэк(О)
Мэк(Ме) = 64,2 – 8 = 56,2 г/моль
ММе = Мэк(Ме) ∙ В. Если В = 1, то МЭ = 56,2 г/моль. Такого металла в таблице Д.И. Менделеева нет. Если В = 2, то ММе = 112,4 г/моль. Следовательно, металл - кадмий
Ответ: Мэк(Окс) = 64,2 г/моль
Мэк(Ме) = 56,2 г/моль
Ме – Cd
3. Написать уравнения реакций взаимодействия гидроксида железа (III) с хлороводородной кислотой с образованием:
а) хлорида дигидроксожелеза (III);
б) хлорида гидроксожелеза (III);
в) хлорида железа (III).
В каждой реакции вычислить молярную массу эквивалента гидроксида железа (III). В одной из реакций определить массу гидроксида железа (III), необходимую для взаимодействия с 3,65 г хлороводородной кислоты.

| РЕШЕНИЕ:
Мэк (основ.) =  , г/моль , г/моль
 - число гидроксогрупп,
замещенных в данной реакции на кислотный остаток.
По реакциям а), б) и в):
Определяем - число гидроксогрупп,
замещенных в данной реакции на кислотный остаток.
По реакциям а), б) и в):
Определяем 
|
а) HCl + Fe(OH)3 = Fe(OH)2Cl + H2O
 =
= 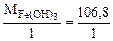 = 106,8 г/моль
= 106,8 г/моль
б) 2HCl + Fe(OH)3 = FeOHCl2 + 2H2O
Mэк[Fe(OH)3] = 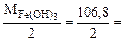 53,4 г/моль
53,4 г/моль
в) 3HCl + Fe(OH)3 = FeCl3 + 3H2O
Mэк[Fe(OH)3] =  35,6 г/моль.
35,6 г/моль.
По закону эквивалентов:

 , т.е.
, т.е. 
Откуда по реакции (в)

 г,
г,
где Mэк[Fe(OH)3] = 35,6 г,моль
Ответ:а)Mэк[Fe(OH)3] = 106,8 г/моль
б) Mэк[Fe(OH)3] = 53,4 г/моль
в) Mэк[Fe(OH)3] = 35,6 г/моль.
 г.
г.
 3. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
3. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
УРОВЕНЬ B
1. Плотность 6% водного раствора ортофосфорной кислоты равна 1,031 г/см3. Рассчитать:
а) молярную концентрацию;
б) моляльность;
в) молярную долю кислоты в растворе.
Дано:

| РЕШЕНИЕ:
а) Молярную концентрацию кислоты определяем по формуле:

|
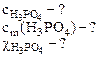
|
Согласно условию задачи в 100 г раствора содержится 6 г
Н3РО4. Тогда 6 г Н3РО4 содержится в объеме раствора
 ;
;
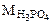 = 1·3 +31+16·4 =98 г/моль
= 1·3 +31+16·4 =98 г/моль
Следовательно,  ,
,
где 10-3 - пересчет см3 в л.
б) моляльность кислоты в растворе определяем по формуле:
|
|
|


Тогда 
где 1000 - коэффициент пересчета г в кг.
в) молярную долю кислоты определяют по формуле:
 = =
= =  = 0,011
= 0,011



2. Определить объем 16%-ного раствора карбоната калия плотностью 1,149 г/см3, необходимого для приготовления 3 л 0,2 М водного раствора данного вещества. Пояснить процесс приготовления раствора.
Дано:

| РЕШЕНИЕ:
а) Молярную концентрацию карбоната калия определяем по формуле:

|

|
Следовательно:


 = 2·39 + 12 +16·3 =138 г/моль
= 2·39 + 12 +16·3 =138 г/моль
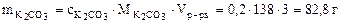
Рассчитываем массу 16%-ного раствора К2СО3, который содержит 82,8 г К2СО3.
Составляем пропорцию:
100 г р-ра - 16 г К2СО3
mр-ра(16%) - 82,8 г К2СО3.
mр-ра(16%) =  517,5 г,
517,5 г,
Определим объём 16% - ного раствора:
 450,4 см3
450,4 см3
Ответ: для приготовления 3 л 0,2 М раствора К2СО3 нужно взять 450,4 мл 16%-ного раствора К2СО3 и разбавить его водой до 3 л.
3. Найти массы воды и кристаллогидрата CuSO4·5H2O, необходимые для приготовления 2 литра раствора, содержащего 8% мас. безводной соли. Плотность 8%-го раствора CuSO4 равна 1,084 г/см3.
Дано:
Vр-ра = 2 л
ω  = 8%
ρр-ра= 1,084 г/см3 = 8%
ρр-ра= 1,084 г/см3
| РЕШЕНИЕ
Массу безводной соли (CuSO4), необходимую для приготовления заданного раствора определяем из формулы:
ω  = =  , % , %
|

|
откуда 
Масса раствора равна

 , где 103 коэффициент перевода л в см3. Тогда масса CuSO4 в растворе составляет:
, где 103 коэффициент перевода л в см3. Тогда масса CuSO4 в растворе составляет:
 ,
,
Массу CuSO4·5H2O, содержащую 86,7 г CuSO4, определяем из пропорции:
 250 г/моль -160 г/моль
250 г/моль -160 г/моль 
 - 173,4 г
- 173,4 г
где
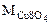 = 64+32+16·4=160 г/моль
= 64+32+16·4=160 г/моль
 = 64+32+16·4 +5·(1·2+16)=250 г/моль
= 64+32+16·4 +5·(1·2+16)=250 г/моль
Тогда

Зная массу раствора и кристаллогидрата, определяем массу воды, необходимую для приготовления заданного раствора:

Ответ: 
|
|
|



 =16,25 г
В = 2
=16,25 г
В = 2
 6,52 л
Т = 298 К
Робщ = 730 мм рт.ст
6,52 л
Т = 298 К
Робщ = 730 мм рт.ст
 3,79 л
Т = 293 К
3,79 л
Т = 293 К
 = 740 мм рт.ст.
Мэк(Окс) -?
Мэк(Ме) -?
Ме -?
= 740 мм рт.ст.
Мэк(Окс) -?
Мэк(Ме) -?
Ме -?
 = 3,65 г
Fe(OH)3
Mэк[Fe(OH)3] -?
= 3,65 г
Fe(OH)3
Mэк[Fe(OH)3] -?
