 |
Скорость химических реакций и химическое равновесие
|
|
|
|
УРОВЕНЬ В
1. При погружении цинковой пластины в раствор хлороводородной кислоты за одно и то же время при температуре 293 К выделилось 8 см3 водорода, а при температуре 303 К – 13 см3 водорода. Водород собран над водой при давлении 740 мм рт. ст. Рассчитать энергию активации протекающей реакции. Давление паров воды при температуре 293 К составляет 17,54 мм рт. ст., а при температуре 303 К - 31,82 мм рт. ст.
| РЕШЕНИЕ:
Zn + 2HCl = ZnCl2 + H2↑
Из уравнения
 выражаем
энергию активации выражаем
энергию активации
 (5.3) (5.3)
|
Скорость гетерогенной реакции определяем по уравнению:
 , моль/(см2·мин) (5.4)
, моль/(см2·мин) (5.4)
где 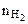 - количество моль выделяющегося водорода;
- количество моль выделяющегося водорода;
S – площадь цинковой пластины, см2;
τ – время протекания реакции, мин.
Определяем отношение скоростей выделения водорода при двух различных температурах (площадь пластины и время протекания реакции постоянны):
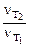 =
= 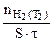 :
: 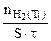 =
= 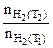 (5.5)
(5.5)
По уравнению Менделеева-Клапейрона
P 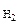 V
V 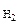 = n
= n 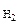 R T, а так как P
R T, а так как P 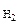 = (Р – P
= (Р – P 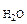 ), то
), то
(P – P 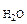 )V
)V 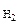 = n
= n 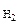 R T, (5.6)
R T, (5.6)
где Р – общее давление газов, мм. рт. ст;
P 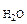 - давление насыщенного водяного пара при температуре опыта, мм. рт. ст.;
- давление насыщенного водяного пара при температуре опыта, мм. рт. ст.;
V 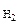 - объем выделившегося водорода, см3;
- объем выделившегося водорода, см3;
Т - температура опыта, К;
R -универсальная газовая постоянная.
Из уравнения (5.6) n 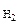 = (Р – P
= (Р – P 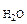 ) V
) V 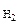 / R T (5.7)
/ R T (5.7)
Подставив выражение (5.7) для температур Т1 и Т2 в отношение (5.5), получим
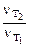 =
= 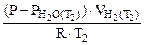 :
: 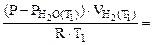
= 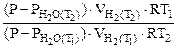

Откуда 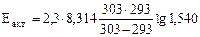 = 31834 Дж/моль =
= 31834 Дж/моль =
= 31,83 кДж/моль
Ответ: 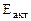 = 31,83 кДж/моль.
= 31,83 кДж/моль.
2. На основании принципа Ле Шателье определить, в каком направлении сместится равновесие:
2SO2(г) + O2(г) <=> 2SO3(г), ΔrH0(298K) = -284,2 кДж, при:
а) понижении температуры, б) повышении концентрации SO3, в) повышении давления. Записать выражение для константы равновесия реакции. Ответы обосновать.
|
|
|
Дано:
Уравнение реакции
ΔrH0(298K)=-284,2 кДж
 Определить направление смещения равновесия при изменении Т, Р, С
Определить направление смещения равновесия при изменении Т, Р, С 
| РЕШЕНИЕ: Выражение константы равновесия реакции может быть приведено в зависимости от равновесных парциальных давлений газообразных участников реакции (5.8) или от их равновесных концентраций (5.9): |
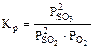 , (5.8)
, (5.8) 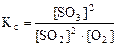 . (5.9)
. (5.9)
а) Выражение зависимости константы равновесия от термодинамических характеристик реакции имеет вид:
-2,3RTlgKP = ΔrH0(298K) – T . ΔrS0(298K), откуда
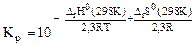 . Смещение равновесия реакции при изменении температуры зависит от знака изменения стандартной энтальпии реакции ΔrH0(298K). Так как ΔrH0(298K)<0, то при понижении температуры показатель степени
. Смещение равновесия реакции при изменении температуры зависит от знака изменения стандартной энтальпии реакции ΔrH0(298K). Так как ΔrH0(298K)<0, то при понижении температуры показатель степени 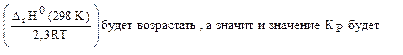 возрастать.
возрастать.
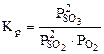 возрастает при увеличении числителя и уменьшении знаменателя, а это возможно при протекании прямой реакции, т.е равновесие 2SO2(г) + O2(г) <=> 2SO3(г) будет смещено вправо (→).
возрастает при увеличении числителя и уменьшении знаменателя, а это возможно при протекании прямой реакции, т.е равновесие 2SO2(г) + O2(г) <=> 2SO3(г) будет смещено вправо (→).
б) Константа равновесия 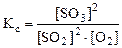 остается величиной постоянной при любом изменении концентрации участников реакции. Поэтому при повышении концентрации SO3 (числитель) при неизменном значении КС должны автоматически возрасти концентрации исходных веществ (знаменатель), а это возможно при протекании обратной реакции, т.е. в этом случае равновесие сместится влево (←).
остается величиной постоянной при любом изменении концентрации участников реакции. Поэтому при повышении концентрации SO3 (числитель) при неизменном значении КС должны автоматически возрасти концентрации исходных веществ (знаменатель), а это возможно при протекании обратной реакции, т.е. в этом случае равновесие сместится влево (←).
в) В соответствии с принципом Ле Шателье увеличение давления смещает равновесие в сторону той реакции, которая сопровождается уменьшением давления или уменьшением суммарного числа моль газообразных веществ.
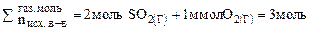 (газ)
(газ)
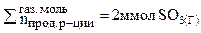 = 2моль(газ)
= 2моль(газ)
Следовательно, при повышении давления равновесие системы смещается вправо (→).
3. Вычислить константу равновесия для гомогенной системы 4NH3(г) +3O2(г) <=> 2N2(г) + 6H2O(г), если исходные концентрации NH3(г) и O2(г) соответственно равны 6,0 и 5,0 моль/л, а равновесная концентрация N2(г) равна 1,8 моль/л.

| РЕШЕНИЕ:
 . (5.11)
Расчет количеств прореагировавших и образовавшихся при установлении равновесия веществ проводится по уравнению реакции.
Равновесная концентрация исходных . (5.11)
Расчет количеств прореагировавших и образовавшихся при установлении равновесия веществ проводится по уравнению реакции.
Равновесная концентрация исходных
|
веществ равна разности исходной концентрации и концентрации прореагировавших веществ. Равновесная концентрация продуктов реакции равна количеству образовавшихся продуктов реакции, т.к. в исходном состоянии их количество было равно нулю.
Обозначим через х количество моль прореагировавших или образовавшихся веществ. Тогда с учетом коэффициентов в уравнении реакции отношения концентраций во второй строке под уравнением реакции равны: (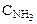 :
: 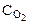 :
: 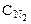 :
: 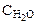 = 4:3:2:6).
= 4:3:2:6).
Последовательность расчетов равновесных концентраций веществ, участвующих в реакции, показана ниже:
| 4NH3 + 3O2 <=> 2N2 + 6H2O | |||||
| Исходная концентрация веществ, моль/л |
 6,0
6,0
| 5,0 | 
|

| |
| Прореагирова-ло, моль/л |
- 4х

|
- 3х 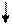
| Образо-валось, моль/л |
+ 2х

|
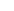 + 6х + 6х

|
| Равновесная концентрация веществ, моль/л | 6,0-4х | 5,0-3х | 2х | 6х |
По условию задачи равновесная концентрация N2 равна 1,8 моль/л. В то же время [N2] = 2х. Следовательно, 2х = 1,8,
а х = 0,9. Тогда равновесные концентрации веществ равны, моль/л:
[NH3] = 6,0-4·0,9 = 2,4 моль/л,
[O2] = 5,0-3·0,9 = 2,3 моль/л,
[N2] = 1,8 моль/л,
[H2O] = 6,0·0,9 = 5,4 моль/л.
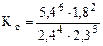 =198,95.
=198,95.
Ответ: Kс = 198,95.
6. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
РАСТВОРОВ
УРОВЕНЬ В
1. Определить давление насыщенного пара воды над 0,05 М раствором хлорида кальция (ρ = 1,041 г/см3) при 301К, если давление насыщенного пара над водой при этой температуре равно 3,78 кПа. Кажущаяся степень диссоциации хлорида кальция равна 0,85.

| РЕШЕНИЕ:
Давление насыщенного пара воды над раствором электролита равно:
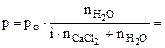
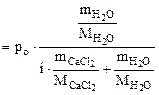 , (6.4) , (6.4)
|
где  - количество воды, моль,
- количество воды, моль,
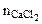 - количество CaCl2, моль
- количество CaCl2, моль
i – изотонический коэффициент.
α = 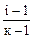 , i = α (к-1) + 1 (6.5)
, i = α (к-1) + 1 (6.5)
где α – кажущаяся степень диссоциации CaCl2
к – общее количество ионов, образующихся при полной
диссоциации одной молекулы CaCl2.
CaCl2 = Сa2+ + 2Cl-
к = 3
i = 0,85(3-1)+1 = 2,7
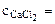
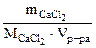 , моль/л, (6.6)
, моль/л, (6.6)
oткуда 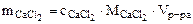 , г
, г
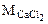 = 111 г/моль
= 111 г/моль
Для расчета берем 1л раствора
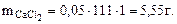
mр-ра = Vр-ра·ρ = 1000∙1,041 = 1041г.
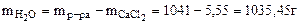
р = 3,78∙  = 3,77 кПа.
= 3,77 кПа.
Ответ: давление насыщенного пара над раствором равно 3,77 кПа.
|
|
|
1. Определить осмотическое давление 1,5% раствора карбоната натрия при 250С. Плотность раствора равна 1,015 г/см3. Кажущаяся степень диссоциации карбоната натрия равна 0,9.

| РЕШЕНИЕ:
π = i∙ 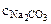 ∙R∙T, кПа (6.7)
α = ∙R∙T, кПа (6.7)
α = 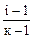 ; i = α(к-1)+1 ; i = α(к-1)+1
|
где α - кажущаяся степень диссоциации,
к – общее количество ионов, образующихся при полной
диссоциации одной молекулы Na2CO3
Na2CO3 = 2Na+ + CO32-
к = 3, тогда i = 0,9(3-1)+1 = 2,8
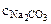 - молярная концентрация Na2CO3, моль/л
- молярная концентрация Na2CO3, моль/л
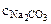 =
= 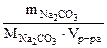 , моль/л
, моль/л
В 100 г 1,5%-ного раствора содержится 1,5 г Na2CO3
Vр-ра = 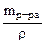 =
= 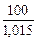 = 98,5см3 = 0,0985 л.
= 98,5см3 = 0,0985 л.
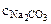 =
= 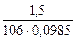 = 0,144 моль/л
= 0,144 моль/л
π = 2,8∙0,144∙8,314∙298 = 998,96 кПа
Ответ: осмотическое давление 1,5% раствора Na2CO3 равно 998,96 кПа.
3. Определить кажущуюся степень диссоциации соли, если водный раствор хлорида алюминия с массовой долей 1,5% кристаллизуется (замерзает) при температуре (-0,690С).
 =1,86 кг·К/моль.
=1,86 кг·К/моль.

| РЕШЕНИЕ:
α = 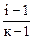 ,
где к – общее количество ионов, образующихся при полной диссоциации одной молекулы AlCl3 ,
где к – общее количество ионов, образующихся при полной диссоциации одной молекулы AlCl3
|
AlCl3 = Al3+ + 3Cl- к = 4
∆tзам = i∙  ∙сm(AlCl3), (6.8)
∙сm(AlCl3), (6.8)
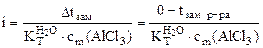
где сm(AlCl3) = 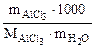 , моль/кг
, моль/кг
В 100г 1,5%-ного раствора содержится 1,5г AlCl3 и 98,5 г воды.
сm(AlCl3) = 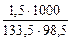 = 0,114 моль/кг,
= 0,114 моль/кг,
 = 133,5 г/моль
= 133,5 г/моль
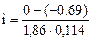 = 3,25
= 3,25
α = 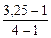 = 0,75 (75%)
= 0,75 (75%)
Ответ: кажущаяся степень диссоциации AlCl3 равна 0,75(75%).
 7. РАСТВОРЫ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ.
7. РАСТВОРЫ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ.
УРОВЕНЬ В
1. Рассчитать рН раствора, полученного смешением 25 см3 0,1М раствора HCl, 20 см3 0,2М раствора NaOH и 50 см3 воды.
Дано:
 = 20см3 = 20см3
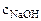 = 0,2 моль/л = 0,2 моль/л
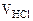 = 25см3 = 25см3
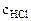 = 0,1 моль/л = 0,1 моль/л
|
| рН -? |
РЕШЕНИЕ:
NaOH + HCl → NaCl + H2O (7.5)
Рассчитываем химическое количество исходных веществ:
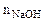 =
= 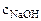 ·
·  = 0,2 ·20·10-3 = 4·10-3 = 0,004 моль,
= 0,2 ·20·10-3 = 4·10-3 = 0,004 моль,
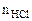 =
= 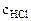 ·
· 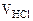 = 0,1·25·10-3 = 2,5·10-3 = 0,0025 моль
= 0,1·25·10-3 = 2,5·10-3 = 0,0025 моль
10-3 – коэффициент перевода мл в л.
Из уравнения реакции (7.5) следует, что число моль NaOH, вступившего в реакцию, равно числу моль HCl.
Определяем вещество, оставшееся в избытке:
0,004 моль > 0,0025 моль.
Следовательно, в избытке, который определяет рН среды остался NaOH.
Тогда количество избыточного NaOH в растворе:
|
|
|
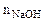 = 0,004 - 0,0025 = 0,0015 моль.
= 0,004 - 0,0025 = 0,0015 моль.
Учитывая, что суммарный объем раствора складывается из объемов двух растворов и воды,
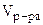 =
= 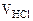 +
+  +
+  = 25·10-3 + 20·10-3 + 50·10-3 = 95·10-3л,
= 25·10-3 + 20·10-3 + 50·10-3 = 95·10-3л,
Молярная концентрация NaOH равна:
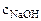 =
=  = 0,016 моль/л.
= 0,016 моль/л.
Так как диссоциация NaOH протекает по уравнению:
NaOH = Na+ + OH-, то
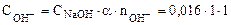 = 0,016 моль/л.
= 0,016 моль/л.
рОН = - lg 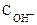 = - lg 0,016 = 1,80.
= - lg 0,016 = 1,80.
рН = 14 – рОН,
рН = 14-1,80 = 12,20.
Ответ: рН = 12,20.
2. Определить, образуется ли осадок, если смешали 100 см 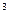 0,01М водного раствора хлорида кальция и 200 см
0,01М водного раствора хлорида кальция и 200 см 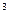 0,02М водного раствора карбоната натрия.
0,02М водного раствора карбоната натрия.
Дано:
с  = 0,01M
с = 0,01M
с  = 0,02M
V = 0,02M
V  = 100 cм = 100 cм 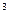 V
V  = 200 cм = 200 cм 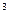
|
| Образуется ли осадок? |
РЕШЕНИЕ:
При смешении растворов протекает следующая реакция:
СaCl2+Na2CO3= CaCO3↓+ NaCl (7.6)
Осадок CaCO 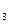 образуется только в случае, если
образуется только в случае, если
с 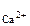 ·с
·с 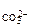 >ПР
>ПР 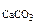 =5·10
=5·10  (табл.)
(табл.)
Поскольку смешали 100 cм 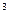 раствора CaCl
раствора CaCl 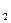
 и 200 cм
и 200 cм 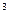 Na
Na 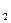 CO
CO 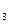 , то объем раствора после смешения составляет 300 cм
, то объем раствора после смешения составляет 300 cм 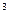 . После смешения с учетом разбавления растворов концентрации ионов Ca2+ и CO
. После смешения с учетом разбавления растворов концентрации ионов Ca2+ и CO 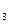 2- будут равны:
2- будут равны:
с 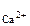 =
= 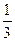 с
с  ·
·  ·n
·n 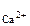 ; с
; с 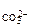 =
=  с
с 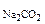 ·
·  ·n
·n 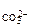
CaCl  и Na
и Na 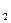 CO
CO 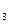 - сильные электролиты,
- сильные электролиты,  = 1.
= 1.
Процессы диссоциации CaCl 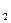 и Na
и Na 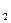 CO
CO 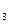 протекают по следующим уравнениям:
протекают по следующим уравнениям:
CaCl 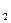 = Ca
= Ca 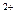 +2Cl
+2Cl 
Na 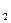 CO
CO 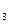 = 2Na
= 2Na 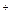 +CO
+CO 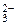
следовательно, n 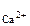 = 1 и n
= 1 и n 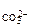 = 1.
= 1.
с 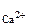 =
= 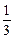 0,01·1·1 = 3,3·10
0,01·1·1 = 3,3·10 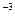 моль/л,
моль/л,
с 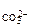 =
= 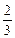 0,02·1·1 = 1,3·10
0,02·1·1 = 1,3·10 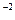 моль/л.
моль/л.
с 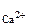 ·с
·с 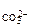 = 3,3·10
= 3,3·10 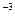 ·1,3·10
·1,3·10 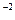 = 4,29·10
= 4,29·10 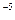
Так как 4,29·10-5 > 5·10-9 (ПР 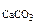 ), то осадок CaCO
), то осадок CaCO 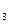 образуется.
образуется.
Ответ: осадок CaCO 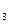 образуется.
образуется.
3.Вычислить рН 0,0IM водного раствора HNO2, содержащего, кроме того, 0,02 моль/л KNO2.
Дано:
с 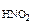 = 0,01 M
с = 0,01 M
с  = 0,02 M = 0,02 M
|
| рН -? |
РЕШЕНИЕ:
рН = - lg с 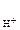
HNO2 <=> H+ + NO 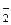 (7.7)
(7.7)
KNO2 = K+ + NO 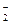 (7.8)
(7.8)
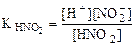
Прибавление KNO2 к раствору HNO2 смещает равновесие диссоциации HNO2 влево за счет увеличения концентрации иона NO2-. В результате, в системе устанавливается равновесие при новых концентрациях Н+ и NO 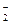 , но значение константы диссоциации HNO2 при этом остается прежним.
, но значение константы диссоциации HNO2 при этом остается прежним.
Тогда обозначим равновесную концентрацию ионов [Н+] в новых условиях через х:
[H+] = х моль/л.
Общая равновесная концентрация иона [NO 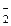 ] равна сумме концентраций иона NO
] равна сумме концентраций иона NO 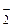 , образовавшегося при диссоциации HNO2 и при диссоциации KNO2:
, образовавшегося при диссоциации HNO2 и при диссоциации KNO2:
[NO 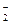 ] = с
] = с 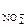 + с
+ с 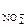 .
.
из HNO2 из KNO2
Концентрация ионов NO 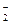 , образовавшихся при диссоциации HNO2, равна х моль/л, так как при диссоциации 1 моль HNO2 образуется 1 ион Н+ и 1 ион NO
, образовавшихся при диссоциации HNO2, равна х моль/л, так как при диссоциации 1 моль HNO2 образуется 1 ион Н+ и 1 ион NO 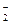 (из уравнения 7.7).
(из уравнения 7.7).
Концентрация ионов NO 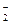 , образовавшихся при диссоциации КNO2 равна: с
, образовавшихся при диссоциации КNO2 равна: с  = с
= с  ·α·n
·α·n  = 0,2·1·1 = 0,2 моль/л (из уравнения 7.8.),
= 0,2·1·1 = 0,2 моль/л (из уравнения 7.8.),
КNO2 - сильный электролит, α = 1, n 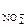 = 1.
= 1.
тогда [NO 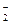 ] = (х + 0,02) моль/л
] = (х + 0,02) моль/л
Равновесная концентрация недиссоциированных молекул
[HNO2] = (0,01 – х) моль/л.
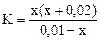 = 4·10-4, (табл.)
= 4·10-4, (табл.)
так как, х << 0,01 моль/л, то значением х, ввиду его малого значения, в выражениях (х+0,02) и (0,01- х) можно пренебречь, и данное выражение записать в виде:
 ; откуда х = [H+] = 2 · 10-4 моль/л
; откуда х = [H+] = 2 · 10-4 моль/л
рН = -lg(2·10-4) = 3,7
Ответ: рН = 3,7
ГИДРОЛИЗ СОЛЕЙ
|
|
|
УРОВЕНЬ В
1. Составить ионно-молекулярное и молекулярное уравнения гидролиза карбоната калия (K2CO3). Вычислить константу, степень и рН гидролиза соли в 0,01М растворе.
| РЕШЕНИЕ: |
 |
K2 CO3 + H2O <=> KHCO3 + KOH
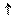
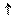 KOH + H2 CO3
KOH + H2 CO3
|
|

 СО32 - + Н ОН <=> +, рН>7, среда
СО32 - + Н ОН <=> +, рН>7, среда
 щелочная
щелочная
Kг = 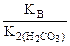 ,
,
 (табл.).
(табл.).
Kг = 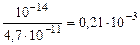 ,
,
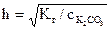 ,
,  =0,14,
=0,14,
pH+ рОН=14.
Так как среда щелочная, то определяем 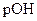 :
:
pОН= -1/2∙lgKг -1/2∙lg 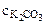 =
=
= 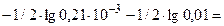 2,84
2,84
рН = 14-рОН, рН = 14-2,84=11,16,
Ответ: 
2. Рассчитать при температуре 300К константу, степень и рН гидролиза нитрат аммония (NH4NO3) в 1М растворе, используя значения термодинамических характеристик реакции гидролиза соли. Написать ионно-молекулярное и молекулярное уравнение гидролиза этой соли.
∆гНо(298 К) = 51,14 кДж;
∆гSo(298 K) = - 4,67 Дж/К.
| РЕШЕНИЕ: |
NH4 NO3 + H2O <=> NH4OH + HNO3
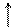
 NH 4OH + HNO3
NH 4OH + HNO3
|
NH4 + + H OH <=> NH4OH +, pH<7, среда


 кислая
кислая
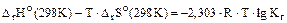 (8.1)
(8.1)

 ,
,
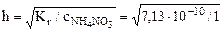 =2,67·10-5
=2,67·10-5
Т.к. среда кислая, то определяем рН:



 ,
,
рН = -1/2∙(-9,15)-1/2∙lg1= 4,60.
Ответ: 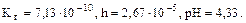
3. Какая из двух солей хлорид цинка (ZnCl2) или хлорид меди (СuCl2), при равных концентрациях в большей степени подвергается гидролизу? Ответ мотивировать расчетом отношения степеней гидролиза обеих солей. Составить ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Дано:
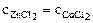
| РЕШЕНИЕ: |
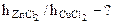
|

 Zn Cl2 + H2O <=> ZnOHCl + HCl
Zn Cl2 + H2O <=> ZnOHCl + HCl
Zn (OH)2 + HCl
|
|

 Zn 2+ + H OH < = > +, рН < 7 - среда
Zn 2+ + H OH < = > +, рН < 7 - среда
 кислая
кислая
Cu Cl2 + H2O < = > CuOHCl + HCl

 Cu (OH)2 + HCl
Cu (OH)2 + HCl
|
|
Cu2+ + H OH < = > +, рН < 7 - среда


 кислая
кислая
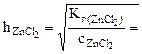
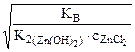 ,
,
 (табл.).
(табл.).
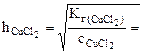
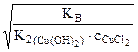
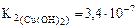 (табл.)
(табл.)
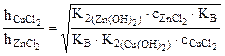 =
=  =
=
= 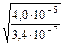 = 10,85.
= 10,85.
Ответ: Степень гидролиза CuCl2 в 10,85 раз больше степени гидролиза ZnCl2, поэтому CuCl2 в большей степени подвергается гидролизу, чем ZnCl2.
|
|
|




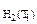 = 8 см3,
= 8 см3,
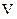
 = 13 см3,
P
= 13 см3,
P 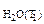 = 21,07 мм рт.ст.
P
= 21,07 мм рт.ст.
P  =31,82 мм рт.ст.
P = 740 мм рт.ст.
=31,82 мм рт.ст.
P = 740 мм рт.ст.
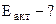 τ
τ  -?
-?

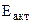 -?
-?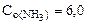 моль/л,
моль/л,
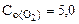 моль/л,
[N2] = 1,8 моль/л
Kс -?
моль/л,
[N2] = 1,8 моль/л
Kс -?
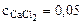 моль/л
T = 301К
ρ = 1,041 г/см3
α = 0,85
рo = 3,78 кПа
р -?
моль/л
T = 301К
ρ = 1,041 г/см3
α = 0,85
рo = 3,78 кПа
р -?
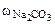 = 1,5%
t = 250С
ρ = 1,015 г/см3
α = 0,9
π -?
= 1,5%
t = 250С
ρ = 1,015 г/см3
α = 0,9
π -?
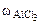 = 1,5%
tзам р-ра = -0,690С
= 1,5%
tзам р-ра = -0,690С
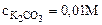 Kг -? h -? pH-?
Kг -? h -? pH-?
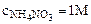 T=300K
Kг-? h-? pH-?
T=300K
Kг-? h-? pH-?
