 |
2.2 Метод Сэнгера (остановка синтеза ДНК ферментом на дидезоксинуклеотидах (ddNTP))
|
|
|
|
2. 2 Метод Сэнгера (остановка синтеза ДНК ферментом на дидезоксинуклеотидах (ddNTP))
 В 1975 г Фредерик Сэнгер и Алан Кулзониз из лаборатории молекулярной биологии Кембриджского университета (Великобритания) предложили метод определения последовательности ДНК, основанный на использовании ДНК-полимеразы и радиоактивно меченных нуклеотидов, который получил название " плюс-минус" секвенирования. Впоследствии метод был усовершенствован посредством использования дидезоксинуклеозидтрифосфатов, встраивание которых в синтезируемую цепочку ДНК приводит к остановке дальнейшего синтеза. Данный метод получил название метода Сэнгера.
В 1975 г Фредерик Сэнгер и Алан Кулзониз из лаборатории молекулярной биологии Кембриджского университета (Великобритания) предложили метод определения последовательности ДНК, основанный на использовании ДНК-полимеразы и радиоактивно меченных нуклеотидов, который получил название " плюс-минус" секвенирования. Впоследствии метод был усовершенствован посредством использования дидезоксинуклеозидтрифосфатов, встраивание которых в синтезируемую цепочку ДНК приводит к остановке дальнейшего синтеза. Данный метод получил название метода Сэнгера.
Основной идеей метода является использование модифицированных нуклеотидов - дидезоксинуклеозидтрифосфатов (ddNTP) (Рис. 19).

Рис. 19 Структурные формулы нуклеотидов, используемых для обычного синтеза (А) и остановки синтеза ДНК (В)
В отличие от обычного субстрата ДНК-полимеразы, дезоксинуклеозидтрифосфатов (dNTP), ddNTP не несут ОН-группы в 3ʹ -положении дезоксирибозы и вследствие этого не способны к присоединению ДНК-полимеразой следующего нуклеотида. Фрагмент ДНК, последовательность которого требуется определить, добавляется в реакцию аналогичную ПЦР: реакционная смесь включает термостабильную ДНК-полимеразу, dNTP всех четырех типов и праймеры, выступающие в качестве затравок для синтеза дочерних цепей ДНК.

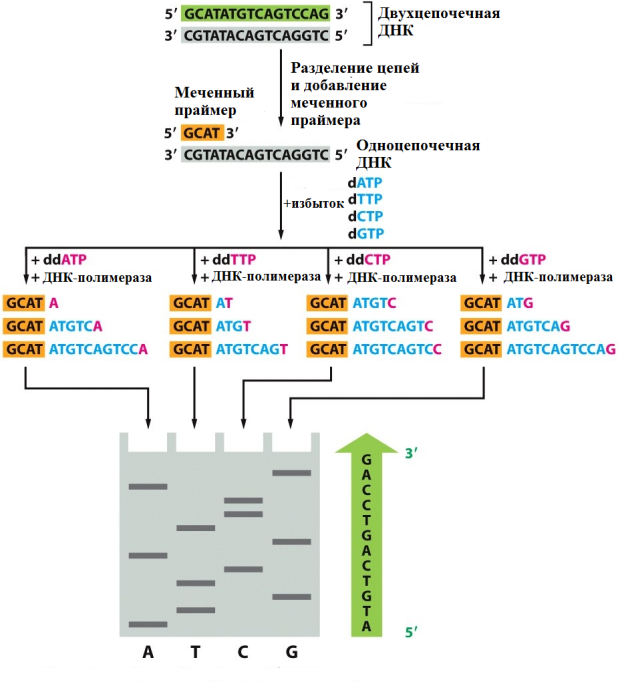
Рис. 20 Принцип метода Сэнгера.
Удлинение цепи ДНК ферментом происходит до момента включения ddNTP. Разделение полученных фрагментов методом электрофореза в геле позволяет определить последовательность нуклеотидов.
Помимо этих компонентов, в реакционную смесь добавляются 4 соответствующих ddNTP (ddA, ddT, ddG и ddC) в концентрациях примерно в 20 раз меньше, чем dNTP. Каждый ddNTP помечен своим флуоресцентным красителем, что позволяет производить анализ в одной пробирке. Ранее для этой цели использовали изотопы P32, а реакцию проводили в 4-х отдельных пробирках для каждого азотистого основания, как и в методе Максама-Гилберта.
|
|
|
В ходе ферментативного синтеза ДНК, в каком-то из положений случайным образом происходит включение в строящуюся цепь меченного ddNTP вместо обычного dNTP, что приводит к остановке синтеза, так как отсутствие 3ʹ -ОН группы блокирует образование фосфодиэфирной связи со следующим нуклеотидом. Реакцию проводят в циклическом режиме (как при ПЦР). Так как ddNTP составляют примерно 5% от dNTP, а мечение включает 40-50 циклов, в конце такой линейной амплификации получается набор одиночных цепей ДНК, отличающихся по длине и всегда заканчивающихся меченным нуклеотидом (Рис. 20).
После мечения проводят разделение полученных одноцепочечных фрагментов методом электрофореза в ПААГ. В настоящее время данный процесс полностью автоматизирован. Автоматические секвенаторы позволяют проводить электрофорез меченных фрагментов ДНК в тонком капилляре, заполненном гелем (Рис. 21).

Рис. 21 Капиллярный автоматический секвенатор ABI 3130xl Applied Biosystems (США)
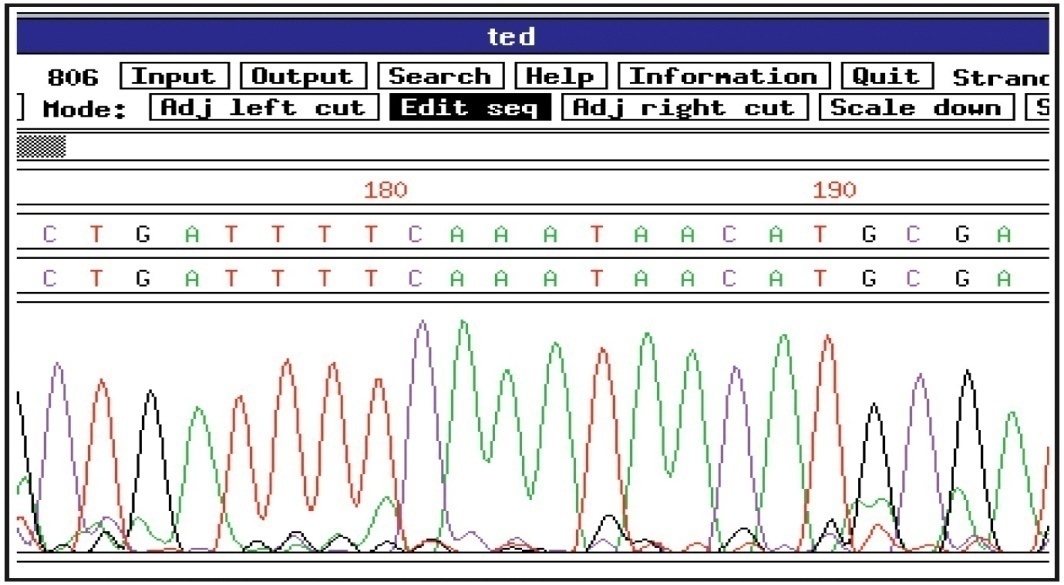
Детекция разделенных фрагментов происходит на дальнем конце капилляра за счет регистрации флуоресценции терминальных ddNTP, проходящих через детектор фрагментов ДНК. В зависимости от типа терминального ddNTP прибор регистрирует флуоресценцию в той или иной области спектра. Данные спектрограммы и прочтение нуклеотидной последовательности отображаются на экране компьютера (Рис. 22).
|
|
|


