 |
Определение бихроматной окисляемости
|
|
|
|
Оборудование и реактивы:
1) Бихромат калия K2Cr2O7, 0,25моль-экв/л (0,25н) раствор. Навеску K2Cr2O7 массой 12,258г переносят в мерную колбу на 1л, растворяют в воде и доводят объем раствора до метки.
2) Тиосульфат натрия Na2S2O3, 0,2моль-экв/л (0,2н) раствор. Навеску Na2S2O3´5Н2О массой 49,64г растворяют в воде в мерной колбе на 1л. Устанавливать нормальность раствора тиосульфата следует не раньше, чем через 10 дней после его приготовления. Если раствор приготовлен на свежекипяченой дистиллированной воде, нормальность его можно устанавливать через 1-2 дня после приготовления.
3) Йодид калия KI, 20% раствор.
4) Крахмал, 1% раствор.
5) Серная кислота Н2SО4 4н раствор.
Ход работы:
В колбу Эрленмейра на 250мл помещают 50мл анализируемой воды, прибавляют 10мл 4н серной кислоты и 10мл 0,25н бихромата калия. В колбу вносят кипелки (стеклянные капилляры или кусочки пористой керамики), накрывают воронкой для предотвращения разбрызгивания, нагревают до кипения и кипятят в течение 10 мин. Переносят колбу в баню с холодной водой и охлаждают до комнатной температуры. К охлажденному раствору приливают 3мл 20%-ного раствора йодида калия, накрывают часовым стеклом, осторожно перемешивают и помещают на 5мин. в темное место для завершения реакции. Выделившийся йод оттитровывают раствором тиосульфата натрия в присутствии индикатора – крахмала, который добавляют после того, как бурая окраска посветлеет. Если переход окраски в конце титрования плохо заметен, перед прибавлением крахмала раствор можно разбавить 50мл дистиллированной воды.
Холостой опыт выполняют аналогично с 50мл дистиллированной воды. Все определения выполняются не менее двух раз.
Окисляемость (ХПК) анализируемой воды в мг О2/л вычисляют по формуле:
|
|
|
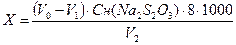 ,
,
где V0 – расход раствора тиосульфата натрия на титрование холостой пробы, мл;
V1 – расход раствора тиосульфата натрия на титрование рабочей пробы, мл;
V2 – объем анализируемой пробы воды, мл;
Cн(Na2S2O3) – нормальность раствора тиосульфата натрия, моль-экв/л;
8 – эквивалент кислорода, г/моль-экв.
Для сравнения определяют перманганатную окисляемость водопроводной воды, которую желательно предварительно отстоять в течении двух часов. Объем пробы водопроводной воды для анализа берут 50 мл. Остальное аналогично предыдущему.
(Лурье, 1984)
Контрольные вопросы
1. Что называют ²окисляемостью² воды?
2. Содержание, каких веществ в воде определяет величину окисляемости воды?
3. В каких случаях определяют перманганатную окисляемость воды?
4. В каких пределах изменяется окисляемость природных вод?
5. Какие факторы окружающей среды влияют на окисляемость поверхностных вод?
6. Что называют теоретическим ХПК сточных вод?
7. Какие окислители используют при экспериментальном определении ХПК сточных вод?
8. Что называют биологическим потреблением сточных вод БПК?
V. ХИМИЯ ЛИТОСФЕРЫ
Лабораторная работа №1
Исследование содержания в почве
Горюче-смазочных материалов (ГСМ)
(работа проводится в вытяжном шкафу)
Теоретическая часть
Загрязнение почв ГСМ относится к числу наиболее опасных, поскольку оно принципиально изменяет свойства почв, а очистка от ГСМ очень сильно затруднена. ГСМ попадают в почву при различных обстоятельствах: при разведке и добыче нефти, при авариях на нефтепроводах, при авариях речных и морских нефтеналивных судов. Различные углеводороды попадают в почву на нефтебазах, бензозаправках и т.п.
Последствия для почв, вызванные ГСМ, можно без преувеличения назвать чрезвычайными. ГСМ обволакивает почвенные частицы, почва не смачивается водой, гибнет микрофлора, растения не получают должного питания. Наконец, частицы почвы слипаются, а сами ГСМ постепенно переходят в иное состояние, их фракции становятся более окисленными, затвердевают, и при высоких уровнях загрязнения почва напоминает асфальтоподобную массу. Бороться с таким явлением очень трудно.
|
|
|
Наиболее перспективным способом удаления ГСМ из грунта является биообработка, основанная на внесении в грунт микроорганизмов-деструкторов углеводородов. Последние исследования показали, что наиболее эффективным из известных бактерий-деструкторов углеводородов является штамм Васillus megaterium 1BD, способный перерабатывать как парафины, так и арены, в том числе и полициклические. Однако для ежегодной очистки тысяч тонн замазученных грунтов необходимо создание специального производства данного штамма. Более того, для эффективного функционирования штамма необходимо искусственное создание питательной среды в замазученном грунте, что также является трудновыполнимой задачей при больших объемах обрабатываемого материала. В то же время на сооружениях биологической очистки сточных вод нефтеперерабатывающих заводов образуется большое количество избыточного активного ила, который не находит в настоящее время квалифицированного применения и является крупнотоннажным отходом. Адаптированный к высокому содержанию углеводородов в среде обитания данный тип активного ила способен при соответствующих условиях снижать концентрацию нефтепродуктов в стоках за несколько часов с 20-50 до 2-3 мг/л. В его состав входят микроорганизмы различных систематических групп: микромицеты, дрожжи и бактерии, многие из которых могут функционировать не только в воде, но и в почве. Так, бактерии-деструкторы углеводородов таких родов как Bacillus Bacterium, Micrococcus, Pseudomonas, Achromobacter, Nocardia и многие другие, входящие в биоценоз активного ила, относятся к аэробным и факультативно-анаэробным микроорганизмам и являются типичными обитателями почвы. Активный ил также является источником азота, калия, фосфора, кальция, магния и микроэлементов, необходимых для жизнедеятельности микроорганизмов-деструкторов. Таким образом, сооружения биологической очистки стоков нефтеперерабатывающих заводов являются крупнотоннажными биореакторами для производства нефтедеструктирующей микробной биомассы, большей частью однородной с почвенной микрофлорой, с помощью которой возможна переработка больших объемов замазученных грунтов. В Волжском районе Самарской области (с. Ровно-Владимировка) с помощью активного ила очистных сооружений ОАО «Куйбышевский НПЗ» за два летних сезона был восстановлен (до фоновых концентраций нефтепродуктов) экспериментальный участок площадью около 2 га, средняя начальная концентрация нефтепродуктов на котором составляла около 3000 мг/кг. Доза активного ила, внесенного однократно, составила 50 мг/кг (Филенков, 2004).
|
|
|
Экспериментальная часть
Оборудование и реактивы:
Коническая колба с пробкой; фильтр; делительная воронка; чашка для выпаривания; весы; дистиллированная вода; диэтиловый эфир.
Ход работы:
Образец почвы массой 10 г поместить в коническую колбу. Прилить 50 мл воды и 50 мл диэтилового эфира (гептана).
Закрыв пробкой интенсивно встряхивать в течение 5 минут.
После отстаивания слить жидкую фазу на фильтр. Промыть после фильтрования 5 мл органического растворителя.
Поместить фильтрат в делительную воронку. Отделить органическую фазу и перенести в предварительно взвешенную чашку для выпаривания.
Полностью выпарить органический растворитель. Взвесить чашку. Рассчитать содержание (ГСМ) в почве в г/кг.
Контрольные вопросы
1. Охарактеризуйте почвенные процессы, вызванные нефтезагрязнением.
2. Назовите перспективный способ удаления ГСМ из грунта.
Лабораторная работа №2
Адсорбция меди в почве
Теоретическая часть
Почва – связующее звено между атмосферой, гидросферой, литосферой и живыми организмами. Она играет важную роль в процессах обмена веществами и энергией между компонентами биосферы. Почва – среда обитания и необходимый элемент существования значительной части флоры и фауны планеты. Тем большую тревогу вызывает постоянно возрастающие масштабы антропогенного загрязнения почвы.
|
|
|
К одним из наиболее опасных химических веществ, загрязняющих почву, относятся тяжелые металлы: медь, свинец, марганец, никель, кадмий, ртуть и др. Они попадают на почвенный покров главным образом аэротехногенным путем с газовыми выбросами различных предприятий.
Тяжелые металлы (с мольной массой более 40) входят в группу консервативных веществ, которые не разлагаются в природных условиях или разлагаются очень медленно. Следствием этого является накопление тяжелых металлов в почве и в растениях. По мере продвижения по пищевой цепи концентрация тяжелых металлов возрастает на несколько порядков. Поэтому необходимо изучение процессов аккумуляции и миграции тяжелых металлов в почвенном покрове.
Медь – один из важнейших микроэлементов, физическая активность меди связана главным образом с включением ее в состав активных центров окислительно-восстановительных ферментов. В растениях медь участвует в синтезе белков, жиров и витаминов. Однако при повышенном содержании медь оказывает токсическое воздействие, как на растения, так и на все последующие компоненты пищевой цепи, включая человека, и может быть причиной различных хронических заболеваний. ПДК меди в почве 100 мг/кг.
Основные источники поступления соединений меди в почву – газовые выбросы тепловых электростанций, металлургических и машиностроительных предприятий. Кроме того, в сельском хозяйстве используют содержащие медь микроудобрения и пестициды.
Трансформация соединений тяжелых металлов в почвенном слое включает в себя следующие процессы: растворение, адсорбция катионов металлов, окислительно-восстановительные реакции, взаимодействие с биотой почвы, аккумуляция в растениях. Основным процессом, контролирующим содержание водорастворимых форм тяжелых металлов в почвах, подверженных техногенному загрязнению, является адсорбционно-десорбционное равновесие.
На скорость процесса адсорбции, ёмкость поглощения и эффективность удерживания в почве влияют различные факторы: заряд и радиус катиона металла, его способность к комплексообразованию, строение и пористость сорбента – почвы. Глинистые составляющие почвы представлены главным образом минералами группы монтмориллионита. Это слоистые водные алюмосиликаты, обладающие сильной способностью к набуханию. Характеризуются большими колебаниями состава, включая различное содержание катионов Ca2+, Na+, Mg2+, Al3+ и Fe3+. Считается, что адсорбция тяжелых металлов почвенными минералами сопровождается или связана с гидролизом металл-катионов:
|
|
|
М2+ + Н2О D МОН+ + Н+
Величина рК этого процесса характеризует адсорбционное поведение металла: с уменьшением значения рК адсорбционная способность металла по отношению к минералу увеличивается. При равных величинах рК тот же эффект наблюдается при увеличении радиуса иона:
| элемент | Cd < | Ni < | Co < | Zn << | Cu < | Pb < | Hg |
| рК | 10.1 | 9.9 | 9.7 | 9.7 | 7.7 | 7.7 | 3.4 |
Приведенный ряд позволяет ожидать достаточно высокой адсорбционной ёмкости глинистых минералов по отношению к катиону меди.
Органическая компонента почвы представлена гумусовыми веществами. Это сложная смесь большого числа полифункциональных органических соединений, которые последовательной экстракцией водным раствором щелочи и подкислением разделяют на более узкие фракции: нерастворимые гумины, гуминовые кислоты, фульвокислоты. Химические вещества этих фракций различаются главным образом по молекулярной массе. Все фракции содержат углерод, водород, кислород, а также 2 – 5% азота и около 1% серы.
Средняя молекулярная масса фульвокислот изменяется от 300 до 3000, а у гуминовых кислот молекулярная масса может превышать 100000.
В гумусовых веществах присутствует как алифатический, так и ароматический углерод.
Кислород в составе гумусовых веществ входит в различные функциональные группы: -ОН (спиртовый и фенольный), –СООН, -С=О, -ОСН3, -СООR. Общее содержание кислорода изменяется от 45% в фульвокислотах до 33% в гуминовых кислотах. Азот входит в состав аминогрупп и гетероциклов.
Как известно, медь обладает высокой комплексообразующей способностью по отношению к кислород-, азот- и серу-содержащим органическим лигандам. Адсорбция металлов в почве противодействует их миграции в глубь по вертикали, но способствует возникновению локальных высоких концентраций с последующим поглощением растениями.
Экспериментальная часть
Оборудование и реактивы:
1. Раствор CuSO4, 0,1н. В мерной колбе ёмкостью 1л. растворяют в воде 12,48г. CuSO4×5Н2О и доводят объём раствора до метки.
2. 0,05н. раствор трилона Б.
3. Ацетатный буфер.
4. Индикатор ПАН, 0,1% спиртовой раствор.
Ход работы:
1. В три конические колбы на 25мл. помещают 20г. воздушно-сухой почвы: песчаной (колба №1), глинистой (колба №2) и торфа (колба №3). В каждую колбу наливают по 50 мл. раствора CuSO4, перемешивают 1 – 3мин. и оставляют на 30мин.
2. Пока устанавливается адсорбционное равновесие между почвой и раствором определяют расход раствора трилона Б на титрование исходного раствора CuSO4 – V0, мл. С этой целью в коническую колбу вносят 5мл. исходного раствора CuSO4, добавляют 3 – 4 капли 2 – 3 капли индикатора ПАН и титруют 0,05н. раствором трилона Б до перехода сиренево-розовой окраски в зеленую. Определение повторяют дважды и V0 находят как среднее значение двух титрований:
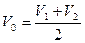 , мл.
, мл.
3. Готовят три сухие конические колбы. В каждую помещают воронку со складчатым фильтром и отфильтровывают образцы почвы.
4. В коническую колбу отбирают пипеткой 5мл. фильтрата, добавляют 3 – 4 капли ацетатного буфера и 2 – 3 капли раствора индикатора ПАН. Титруют раствором трилона Б до перехода сиренево-розовой окраски в зеленую. При этом определяют объём трилона Б, затраченный на титрование фильтрата после адсорбции V1. Такое титрование производят для каждого из трех фильтратов. Результаты титрований заносят в табл.3:
Таблица 3
Результаты измерений
| Вид почвы | Масса почвы а, г. | Объем пробы Vпр, мл. | Расход трилона Б, мл | Адсорбция меди G, мг/г. | |
| V0, мл. | V1, мл. | ||||
| Песок | |||||
| Глина | |||||
| Торф |
Примечание: Vпр – объем пробы взятой для титрования;
V0 – используют среднее значение двух титрований.
5. Последовательность расчёта количества адсорбированной меди.
Расчёт основан на законе эквивалентности, т.е. при титровании в точке эквивалентности количество прореагировавших моль-эквивалентов меди и трилона Б равны.
Находят количество моль-эквивалентов меди в 5мл. исходного раствора nCu:
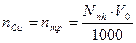
где Nтр – нормальность раствора трилона Б, моль-экв/л. Эквивалент меди равен 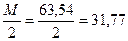 г.
г.
Первоначальное содержание меди во всем растворе, добавленном к почве, m1, мг определяют из соотношения:
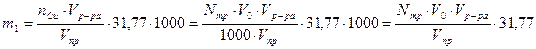 мг. Cu
мг. Cu
где Vр-ра – объём раствора CuSO4добавленный к почве, мл.
соответственно, количество эквивалентов меди 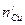 в пробе фильтрата после адсорбции составляет:
в пробе фильтрата после адсорбции составляет:
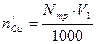
Содержание меди во всем растворе после установления адсорбционного равновесия m2, мг находят аналогично:
 мг. Cu
мг. Cu
Количество адсорбированной меди G в мг. на 1г. почвы рассчитывают по формуле:
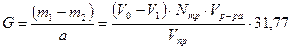
Полученные значения G для разных видов почвы заносят в таблицу 1 и делают вывод о влиянии характера почвенного слоя на его способность удерживать и накапливать катион Сu2+.
(Практикум…, 1987)
Контрольные вопросы
1. Какова положительная и отрицательная роль меди в растениях?
2. Какие Вам известны источники поступления меди в почву?
3. Что является основным процессом, контролирующим содержание водорастворимых форм тяжелых металлов в почвах?
Лабораторная работа №3
|
|
|


