 |
Определение содержания фосфатов в почве
|
|
|
|
В коническую колбу на 250 мл помещают 20 г воздушно-сухой почвы и приливают 50 мл 10 %-ной уксусной кислоты (или 0,1 н HCl), перемешивают в течении 2 – 3 минут и оставляют на 30 минут. Почву отфильтровывают, используя складчатый фильтр. В две мерные колбы на 50 мл вносят пипеткой по 2 мл полученного фильтрата (объем пробы может быть уменьшен до 1 мл или увеличен до 5 мл по указанию преподавателя в зависимости от минерализации почвы). В каждую колбу вносят по 5 мл растворов ванадата аммония, молибдата аммония и азотной кислоты. Доводят объём жидкости в колбах до метки дистиллированной водой, перемешивают и оставляют на 30 мин. Измеряют оптическую плотность растворов при l=440 нм по отношению к дистиллированной воде в кюветах толщиной 10 мм. Получают значения А1 и А2. Находят эти значения на оси ординат калибровочного графика и определяют концентрацию фотометрированных растворов С1 и С2. Для дальнейшего расчёта используют среднее значение:
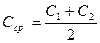 , мг Р/мл.
, мг Р/мл.
Содержание фосфора в почве рассчитывают по формуле:
 ,мг Р на 100г почвы,
,мг Р на 100г почвы,
где: 50 – объём мерной колбы, мл;
Vпр. – объем пробы фильтрата, взятый для анализа, мл;
Vф. – объём раствора кислоты, взятый для экстракции фосфатов из почвы, мл;
m – масса почвы, г.
(Русин, 1990; Коренман, 1982)
Контрольные вопросы
1. Что называют градуировочным графиком? Каким образом и с какой целью его строят?
2. Какие основные пути поступления и эвакуации фосфора в почвенном покрове?
3. В чем заключается негативный эффект повышенного содержания фосфора в почве?
4. Какие соединения фосфора можно определить фотометрическим методом?
 Библиографический список
Библиографический список
1. Акимова Т.А. Экология: Человек – Экономика – Биота – Среда/ Т.А. Акимова, В.В. Хаскин; учебник для вузов. – 2-е изд., перераб. И доп. – М.: ЮНИТИ – ДАНА, 2000. – 566 с.
|
|
|
2. Амбросова Г.Т., Меркель О.М., Бойко Т.А., Хвостова Е.В.Удаление фосфора из городских сточных вод.// Водоснабжение и водоотведение: качество и эффективность. Труды V Международной научно-практической конференции – Кемерово: ОАО «КемВод», СибГИУ, ЗАО «Экспо-Сибирь», 2002.
3. Алексеев Ю.В. Тяжелые металлы в почвах и растениях.-Л.: Агропромиздат, 1987, 142 с.
4. Андруз Дж., Бримблекумб П., Джикелз Т., Лисс П. Введение в химию окружающей среды. Пер. с англ.- М.: Мир, 1999.- 271 с., ил.
5. Ахмадеев В.В., Волков С.В., Костюченко С.В., Красногуб А.В., Кудрявцев Н.Н., Якименко А.В. Применение метода УФ облучение для обеззараживания сточных вод.// Вода и экология: проблемы и решения: С.-Пб., 2000, №2.
6. Безуглова О.С., Орлов Д.С. Биогеохимия. Учебник для студентов высших учебных заведений. Серия «Учебники, учебные пособия». – Ростов н/Д: «Феникс», 2000.- 320 с.
7. Бернал Дж. Возникновение жизни/ Дж. Бернал; Пер. с англ. И.Б. Бухвалова, Ю.И. Лашкевича, К.А. Любарского; Под ред. А.И. Опарина.-М.: Мир, 1969. – 392 с.
8. Берчфил Б.К. Континентальная кора/ Б.К. Берчфил// В мире науки. – 1983.-№11. – с.60-72.
9. Богданов И. Дым отечества, или Краткая история табакокурения. /Новое литературное обозрение, 2007.
10. Ванюшина А.Я., Кутепов В.В., Данилович Д.А., Козлов М.Н., Мухин В.А., Афанасьев Р.А., Мерзлая Г.Е. Компостирование сброженного осадка Курьяновской станции аэрации.//Водоснабжение и санитарная техника: ООО «Издательство ВСТ», 2002, №12.
11. Вернадский В.И. Биосфера и ноосфера/ В.И. Вернадский. – М.: Айрис-пресс, 2004. – 576 с.
12. Виноградов Л.П. Основные закономерности в распределении микроэлементов между растением и средой.//Микроэлементы в жизни растений и животных, М.:Изд-во АН СССР, 1982, с.7-20.
13. Возная Н.Ф. Химия воды и микробиология: Учебное пособие для вузов. – 2-е изд., перераб. и доп. – М.: Высшая школа, 1979. – 340 с., ил.
14. Войткевич Г.В. Основы теории происхождения Земли/Г.В. Войткевич.-2-е изд., перераб. И доп.-М.:Недра, 1988.-112 с.
|
|
|
15. Войтович Н.В. Плодородие почв Нечерноземной зоны и его моделирование./М., Колос, 1997, с.45.
16. Гадаскина И. Д. Яды – вчера и сегодня: Очерки по истории ядов / И. Д. Гадаскина, Н. А. Толоконцев; Под ред. В. А. Филова. – Л.: Наука, 1988. – 204 с.
17. Гарин В. М. Экология для технических вузов // В. М. Гарин, И. А. Кленова, В. И. Колесников; Под ред. В. И. Колесникова. – Ростов–на–Дону: Феникс, 2001. – 384 с.
18. Герасимов И.П. Научные основы современного мониторинга окружающей среды // Изв. АН СССР. Сер. географ. 1975. №3. С.13-25.
19. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/Под ред. В.А.Рабиновича и Х.М.Рубиной. При участии Т.Е. Алексеевой, Н.Б. Платуновой, В.А. Рабиновича, Х.М. Рубинной, Т.Е.Хрипуновой.-М.:Интеграл-Пресс, 2006.-240 с.
20. Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И. Ермакова.-изд. 30-е, исправленное – М.: Интеграл-Пресс, 2007.- 728 с.
21. Голубовская Э.К. Биологические основы очистки воды. – М.: Высшая школа, 1978.
22. Губанов Л.Н., Филин В.А., Бояркин Д.В., Котов А.В. Особенности использования осадков городских сточных вод в качестве почвоулучшающей добавки. // Вода и экология: проблемы и решения: С.-Пб., 2004, №1.
23. Гумен С.Г., Малышев А.В., Медведев Г.П. Обезвоживание осадков городских сточных вод на центрифугах. //Водоснабжение и санитарная техника: ООО «Издательство ВСТ»,2001, №4.
24. Гюнтер Л.И. Беляева С.Д., Тавризова О.А., Короткова Е.В. Экологически безопасные приёмы обработки и размещения осадков городских сточных вод в окружающей среде.// Чистый город: Академия коммунального хозяйства, 2000, №4(12), октябрь – декабрь.
25. Гусакова Н.В. Химия окружающей среды. Серия «Высшее образование». Ростов-на-Дону: Феникс, 2004.-192 с.
26. Джинлоз Р. Земное ядро/ Р. Джинлоз// В мире науки. – 1983. - № 11. – с.16-27.
27. Ершов Ю.А., Попков В.А., Берлянд А.С. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов; Под ред. Ю.А. Ершова. – 4-е изд., стер.- М.: Высш. шк., 2003.-560 с.: ил.
28. Зилов Е.А. Химия окружающей среды: Учебное пособие / Е. А. Зилов. – Иркутск: Иркут. ун-т, 2006. – 148 с., ил.
29. Иванов В.Г., Хямяйляйнен М.М. Обеззараживание. Альтернатива традиционным методам. // Вода и экология: проблемы и решения: С.-Пб., 2000, №1.
|
|
|
30. Израэль Ю. А. Антропогенная экология океана / Ю. А. Израэль, А. В. Цыбань. – Л.: Гидрометеоиздат, 1989. – 528 с.
31. Ильин В.Б. Тяжелые металлы в системе почва-растение.-Новосибирск, Наука, 1991, 150 с.
32. Ингерсол Э. П. Атмосфера Земли / Э. Ингерсол // В мире науки. – 1983. – № 11. – С. 88–100.
33. Жмур Н.С. Интенсификация процессов удаления соединений азота и фосфора из сточных вод. - М.: АКВАРОС, 2001.-94 с. -ISBN 5-901652-04-5.
34. Жмур Н.С. Методы санитарно-биологического контроля.//Методическое руководство по гидробиологическому контролю нитчатых микроорганизмов активного ила. -М.: АКВАРОС, 1996.
35. Жмур Н.С. Технологические и биохимические процессы очистки сточных вод на сооружениях с аэротенками. - М.: АКВАРОС, 2003.-512 с. -ISBN 5-901652-05-3.
36. Жмур Н.С. Управление процессом и контроль результата очистки сточных вод на сооружениях с аэротенками. - М.: Луч, 1997.-172 с.
37. Журавлёва В.И., Бабкин В.Ф., Журавлев В.Д. Перспективный способ утилизации всех видов осадков станций аэрации в виде товарной продукции.// Водоснабжение и водоотведение: качество и эффективность. Труды V Международной научно-практической конференции – Кемерово: ОАО «КемВод», СибГИУ, ЗАО «Экспо-Сибирь», 2002.
38. Заварзин Г.А. Лекции по природоведческой микробиологии/ Г.А. Заварзин. – М.: Наука, 2003. – 348 с.
39. Заварзин Г.А. Становление биосферы/ Г.А. Заварзин // Вестник РАН. – 2001. – Т. 71, № 11. – с. 988-1001.
40. Заварзин Г.А. Эволюция геосферно-биосферной системы/ Г.А. Заварзин // Природа. – 2003. –№ 1. – с. 27-35.
41. Кабата-Пендиас А. Пендиас Х. Микроэлементы в почвах и растениях./М.: Мир, 1989, 439 с.
42. Клауд П. Биосфера/ П. Клауд // В мире науки. – 1983.- № 11.- с. 102-113.
43. Коренман И.М.. Фотометрический анализ. – М:Химия. 1982.
44. Коростелев П.П.. Лабораторная техника химического анализа. – М:Химия. 1982.
45. Кондратьев К. Я. Экодинамика и геополитика. Т. 1. Глобальные проблемы / К. Я. Кондратьев, В. К. Донченко. – СПб, 1999. – 1032 с.
46. Корте Ф., Бахадир М., Клайн В., Лай Я.П., Парлар Г., Шойнерт И.. Экологическая химия: Пер. С нем./Под ред. Ф, Корте.- М.: Мир, 1996. – 396 с., ил.
47. Крик Ф. Жизнь как она есть. Её зарождение и сущность/ Ф.Крик; Пер. с англ. Е.В. Богатыревой. – М.: Институт компьютерных исследований, 2002.- 158 с.
|
|
|
48. Крупнова Т.Г., Сухарев Ю.И. Химия окружающей среды: Учебное пособие.- Челябинск: Изд. ЮУрГУ, 2005.- Ч.2.-36 с.
49. Кудрявцев Н.Н., Костюченко С.В., Волков С.В, Зайцева С.Г. Опыт и перспективы практического применения обеззараживания сточных вод УФ - излучением. //Водоснабжение и санитарная техника: ООО «Издательство ВСТ», 2004, №1.
50. Кузин А. М. Прикладная радиобиология (теоретические и технические основы) / А. М. Кузин, Д. А. Каушанский. – М.: Энергоиздат, 1981. –
224 с.
51. Кузин А. М. Природный радиоактивный фон и его значение для биосферы Земли / А. М. Кузин. – М.: Наука, 1991. – 117 с.
52. Курьяновская станция аэрации МГП «Мосводоканал». Издательство Прима – Пресс - М, 2004.
53. Лалаян Ю.Г. Экологические аспекты отходов. 2000, 320 с.
54. Лем С. Сумма технологии/ С.Лем; Пер. С польского; Под ред. С. Переслегина и Н. Ютанова. – М.: ООО «Издательство АСТ», 2002. – 668 с.
55. Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. –М:Химия. 1984 – 448 с.
56. Майстренко В.Н., Хамитов Р.З., Будников Г.К. Эколого-аналитический мониторинг суперэкотоксикантов.-М.:Химия, 1996. 319 с.
57. Мазур И. И. Инженерная экология: общий курс. В 2-х т. Т. 2. Справочное пособие / И. И. Мазур, О. И. Молдаванов, В. Н. Шишов; Под. ред. И. И. Мазура. – М.: Высшая школа, 1996. – 655 с.
58. Мак-Кензи Д.П. Мантия Земли/ Д.П. Мак – Кензи// В мире науки.- 1983. - № 11.- с.29-42.
59. Маргелис Л. Роль симбиоза в эволюции клетки/ Л.Маргелис; Пер. с англ. В.Б. Касинова, Е.В. Кунина; Под ред Б. М. Медникова. – М.: Мир, 1983.-352 с.
60. Методика технологического контроля работы очистных сооружений городской канализации. Изд. 3-е, перераб. и доп. М., Стройиздат, 1977.299 с.
61. Методические рекомендации для расчета сооружений биологической очистки сточных вод. - М.: Строительный Университет г. Веймара ГУП «МосводоканалНИИпроект», 2002.
62. Мешалкин А.В., Дмитриева Т.В., Шемель И.Г. Экологическое состояние гидросферы: Учебно-методическое пособие/Под ред. А.П. Коржавого. - Калуга: Издательство научной литературы Н.Ф. Бочкаревой, 2007. – 264 с.
63. Мешалкин А.В., Дмитриева Т.В., Шемель И.Г., Маньшина И.В. Экологическое состояние атмосферы/Под ред. А.П. Коржавого. - Калуга: Издательство научной литературы Н.Ф. Бочкаревой, 2006. – 224 с.
64. Микроэлементы в растениях: поступление, транспотр и физиологические функции./Под ред. Островской Ю.М., Киев: Наук думка, 1987, 181 с.
65. Мингулина Э. И., Масленникова Г. Н., Коровин Н. В., Филиппов Э. Л. Курс общей химии: Учеб. для студ. энергет. спец. вузов./ Под ред. Н. В. Коровина. —2-е изд., перераб. и доп. — М.: Высш. шк., 1990. —446 с., ил.
66. Мишуков Б.Г., Соловьев Е.А. Удаление азота и фосфора на очистных сооружениях городской канализации. Приложение к журналу «Вода и экология», 2004.
|
|
|
67. Муравьев А.Г., Каррыев Б.Б., Ляндзберг А.Р. Оценка экологического состояния почвы. Практическое руководство./Под ред. к.х.н. А.Г.Муравьева. Изд.2-ое, перераб. и дополн.-СПб.: Крисмас+, 2008.-216 с., ил.
68. Мышьяк; Пер. с англ. Ю. Б. Шафирова. – Женева: Всемирная организация здравоохранения, 1985. – 185 с.
69. Небел Б. Наука об окружающей среде: В 2-х т. / Б. Небел; Пер. с англ. М. В. Зубкова, Д. А. Петелина, Т. И. Тарасовой, Н. О. Фоминой. – М.: Мир, 1993. – Т. 2. – 330 с.
70. Озима М. Глобальная эволюция Земли / М. Озима; Пер. с англ. А. В. Шолпо; Под ред. А. А. Маракушева. – М.: Мир, 1990. – 165 с.
71. Опарин А.И. Жизнь. Её происхождение и развитие/ А.И. Опарин. – Изд-во АН СССР, 1960.- 192 с.
72. Орлов В.А. Озонирование воды. - М.: Стройиздат, 1984.-88 с., ил.
73. Перельман А.И. Геохимия биосферы/ А.И. Перельман. – М.: Наука, 1973.-167 с.
74. Петров К. М. Общая экология: взаимодействие общества и природы / К. М. Петров; Учебное пособие для вузов. – 2-е изд., стер. – СПб: Химия, 1998. – 352 с.
75. Практикум по агрохимии. – М:Агрохимиздат. 1987.
76. Пурмаль А.П. Антропогенная токсикация планеты. Часть 1./Соросовский образовательный журнал, №9, 1998.
77. Пурмаль А.П. Антропогенная токсикация планеты. Часть 2./Соросовский образовательный журнал, №9, 1998.
78. Радионуклиды в стеклянной клетке.//Химия и жизнь-2003- №7-8, с.6.
79. Рамад Ф. Основы прикладной экологии: Воздействие человека на биосферу / Ф. Рамад; Пер. с фр. Ю И. Ляхина, А. Г. Попова, А. И. Смирнова; Под ред. Л. Т. Матвеева. – Л.: Гидрометеоиздат, 1981. – 544 с.
80. Реймерс Н. Ф. Экология: Теории, законы, правила, принципы и гипотезы / Н. Ф. Реймерс. – М.: Россия молодая, 1994. – 367 с.
81. Русанова Н.А., Овечкина Г.В. Хлорирование и дехлорирование сточных вод. //Водоснабжение и санитарная техника: ООО «Издательство ВСТ»,2002, №12.
82. Русин Г.Г. Физико-химические методы анализа в агрохимии. – М:Агрохимиздат. 1990.
83. Сивер Р. Динамичная Земля/ Р. Сивер// В мире науки. – 1983. - № 11. с. 4-14.
84. Скиннер Б. Хватит ли человечеству земных ресурсов?/ Б.Скиннер; Пер. с англ. Н.Н. Шатанина; Под ред. А.С. Астахова. – М.: Мир, 1989. – 264 с.
85. Справочник по очистке природных и сточных вод/Л.Л. Пааль, Я.Я. Кару, Х.А. Мельдер, Б.Н. Репин.- М.: Высшая школа, 1994.-336 с. илл.
86. Справочник по современным технологиям очистки природных и сточных вод, и оборудованию. ДАНСЕЕ. Отдел по Датскому сотрудничеству в Области Окружающей Среды в Восточной Европе. В сотрудничестве с Министерством Природных Ресурсов РФ и Федеральным Экологическим Фондом РФ.
87. Сытник К. М. Биосфера. Экология. Охрана природы: Справочное пособие / К. М. Сытник, А. В. Брайон, А. В. Гордецкий; Под ред. К. М. Сытника. – Киев: Наукова думка, 1987. – 524 с.
88. Таубе П.Р., Баранова А.Г. Практикум по химии воды. Учеб. пособие для вузов. – М.: Высшая школа, 1971.
89. Тинсли И. Поведение химических загрязнений в окружающей среде. – М:Мир. 1982.
90. Унифицированные методы анализа вод. – Под ред. Ю.Ю. Лурье. – М.: Химия, 1971.
91. Филенков В.М., Каплан А.Л., Трошинский М.В., Милевский А.С. К вопросу об очистке почвы от нефтепродуктов на основе биоматериалов. Труды Международного Форума по проблемам науки, техники и образования. Том 3./Под редакцией: В.П. Савиных, В.В. Вишневского.-М.: Академия наук о Земле, 2004.-110 с.
92. Франшто Ж. Океаническая кора/ Ж. Франшто// В мире науки. – 1983.- №11. – с.44-59.
93. Хаммер М. Технология обработки природных и сточных вод: Перевод с английского -М.: Стройиздат, 1979.400 с., ил.
94. Хансен Б., Пииртола Л. Использование осадка в качестве источника сырья и энергии. //Водоснабжение и санитарная техника: ООО «Издательство ВСТ»,2001, №4.
95. Черных Н.А., Милащенко Н.З., Ладонин В.Ф. Экотоксикологические аспекты загрязнения почв тяжелыми металлами. М.: Агроконсалт, 1999, 176 с.
96. Чертес К.Л., Стрелков А.К., Быков Д.Е., Седогин М.П., Тараканов Д.И. Утилизация осадков сточных вод в качестве материала для изоляции ТБО. //Водоснабжение и санитарная техника: ООО «Издательство ВСТ»,2001, №6.
97. Чертес К.Л.; Стрелков А.К., Быков Д.Е., Шинкевич М.Ю., Бурлака В.А. Новое направление использования избыточного активного ила.//Водоснабжение и санитарная техника: ООО «Издательство ВСТ»,2001, №5.
98. Чибисова Н.В., Долгань Е.К. Экологическая химия: Учебное пособие / Калинингр. ун-т. - Калининград, 1998. - 113 с.
99. Чибисова Н.В. Практикум по экологической химии: Учебное пособие / Калинингр. ун-т. - Калининград 1999. - 94 с.
100. Шустов С.Б., Шустова Л.В. Химические основы экологии: Учеб. пособие для учащихся шк., гимназий с углубл. изуч. химии, биологии и экологии.-М.: Просвещение, 1994.-239 с.
101. Эрхард Ж. П. Планктон. Состав, экология, загрязнение / Ж. П. Эрхард, Ж. Сежен; Пер. с фр. Н. В. Вышкварцевой, А. Г. Попова; Под ред. Г. Н. ужинской. – Л.: Гидрометеоиздат, 1984. – 256 с.
102. Эткинс Л. Молекулы / Л. Эткинс; Пер. с англ. А. А. Кирюшкина. – М.: ир, 1991. – 216 с.
103. Яковлев С.В., Карелин Я.А., Ласков Ю.М., Калицун В.И. Водоотведение и очистка сточных вод: Учебник для вузов.-М.: Стройиздат, 1996.-591 с.: ил.
104. Яковлев С.В., Карюхина Т.А. Биохимические процессы в очистке сточных вод.-М.: Стройиздат, 1980.
105. Яковлев С.В., Ласков Ю.М. Канализация. Изд. 5-е, перераб. и доп. Учебник для техникумов. М., Стройиздат, 1972, 280 с. с илл.
106. Allaby M. Basics of Environmental Science / M. Allaby. – 2nd Ed. – London & New York: Routledge, 2000. – 323 p.
107. Backer A.J. Accumulation and excluders strategies in the response of plant to heavy metals.// J. Plant Nutr., 1981, V.3, N1-4, p.643-651.
108. Climate Change. Research and Policy: Updates. Part I: Scientific Background. – Seville: EC Joint Centre, 1997. – 36 p.
109. Controles de residus dans les dengrees animales. Abeille Fr. Apiculteur, 1992, N769, p.116-118.
110. Davison W. Controlled reversal of lake acidification by treatment with hosphate fertilizers / W. Davison, D. G. George, N. J. A. Edwards // Nature. – 1995. – Vol. 377. – P. 504–507.
111. Deutscher Bundestag: Schutz der Erdatmosphäre. – Bonn: Deutscher Bundestag, 1988. – 583 p.
112. Gamo M. Ranking the risks of 12 major environmental pollutants that occur in Japan / M. Gamo, T. Oka, J. Nakanishi // Chemosphere. – 2003. – Vol. 53. – P. 277-284.
113. Gribbin J. The hole in the sky / J. Gribbin. – Toronto: Bantam, 1988. – 192 p.
114. Gunn J. M. The potential for restoration of acid damaged lake Trout Lakes / J. M. Gunn, K. H. Mills // Restoration Ecology. – 1998. – Vol. 6. – P. 390– 397.
115. Keller W. Lake water quality improvements and recovering aquatic communities / W. Keller, J. M. Gunn // Restoration and Recovery of an Industrial Region: Progress in Restoring the Smelter–damaged Landscape near Sudbury, Canada. – New York: Springer–Verlag, 1995. – P. 80–87.
116. Maliszewska W., Werzbicka N. The influence of lead, zinc and cooper on the development and activity of microorganisms in soil. Agric. Environ. Quality, 1978, v. 8, p.135.
117. Manahan S. E. Fundamentals of Environmental Chemistry / S. E. Manahan. – CRC Press, 2000. – 1024 p.
118. Miller S.L. A production of amino acids under possible primitive earth conditions/ S.L. Miller// Science. – 1953. – Vol. 117.- P. 528-529.
119. Regional precipitation and surface water chemistry trends in Southeastern Canada / J. E. Clair, P. J. Dillon, J. Ion et al. // Can. J. Fish. Aquat. Sci. – 1995. – Vol. 52. – P. 197–212.
120. Regional trends in aquatic recovery from acidification in North America and Europe / J. L. Stoddard, D. S. Jeffries, A. Lükewille // Nature. – 1999. – Vol. 401. – P. 575–578.
121. Retallack S. We’re changing our climate! Who can doubt it? / S. Retallack,P. Bunyard // The Ecologist. – 1999. – Vol. 29, No. 2. – P. 60–63.
122. Reversibility of acidification of mountain lakes after reduction in nitrogen and sulphur emissions in Central Europe / J. Kopacek, J. Hejzlar, E. Stuchlik et al. // Limnol. Oceanogr. – 1998. – Vol. 43. – P. 357–361.
123. The recovery of crustacean zooplankton communities from acidification: Comparing manipulated and reference lakes / N. D. Yan, W. Keller, K. M. Sommers et al. // Can. J. Fish. Aquat. Sci. – 1996. – Vol. 53. – P. 1301–1327.
[1] Элементы, атомы и изотопы. Элементы состоят из атомов — мельчайших частиц элемента, которые могут принимать участие в химических реакциях. Атомы имеют три основные составляющие: протоны, нейтроны и электроны. Протоны заряжены положительно и несут массу, равную массе атома водорода. Нейтроны не заряжены и имеют массу, равную массе протона. Электроны несут отрицательный заряд, равный (положительному) заряду протонов.
Атомы электронейтральны, поскольку имеют одинаковое количество протонов (Z) и электронов. Величина Z. известна как атомный номер, отражающий химические свойства элемента. Атомный вес одного атома определяется его массовым числом; основная масса атома сосредоточена в ядре.
Массовое число = число протонов (Z) + число нейтронов (N).
Из уравнения видно, что масса элемента может меняться в результате изменения числа нейтронов. Это не влияет на химические свойства элемента (которые определяются величиной Z ). Атомы элемента, различающиеся по массе (т. е. N), называются изотопами.
[2]Радиогенные элементы – элементы, возникшие в результате ядерных реакций распада.
[3] Гадейский эон, который начался, когда Земля превратилась в сплошное твердое тело.
[4] Экотоксиканты – ядовитые вещества антропогенного происхождения, вызывающие серьёзные нарушения в структурах экосистем.
Суперэкотоксиканты – вещества, обладающие полифункциональным токсическим действием в чрезвычайно малых дозах.
[5] Хемосфера – совокупность всех веществ биосферы и природных и антропогенных.
[6] Многие элементы не существуют отдельно в виде атомов, а связаны друг с другом и образуют молекулы. Например, основные компоненты воздуха — кислород и азот — присутствуют в нижней части атмосферы в виде молекул O2 и N2. В отличие от них аргон как инертный элемент (или благородный газ) находится в несвязанной форме в виде отдельных атомов.
Связи в молекулах образуются путем электростатических взаимодействий между электронами и ядрами атомов. Существует множество механизмов, приводящих к образованию связи, а тип связи влияет на свойства образовавшегося в результате вещества. В образование связи вовлечены электроны, наиболее удаленные от центра атома. Прототипом химической связи является ковалентная связь, и, вероятно, можно представить ее наилучшим образом как образующуюся из внешних обобщенных электронов двух атомов. Рассмотрим, например, два атома фтора, образующих молекулу фтора:
На этом изображении химической связи электроны обозначены точками. На самом деле электроны связи размазаны по всей молекуле, но с большей вероятностью они располагаются между ядрами. Связь показана в виде двух электронов, находящихся между атомами, т. е. связь образуется двумя электронами, общими для обоих атомов. Следовательно, образование связи можно рассматривать как результат достижения структуры, подобной благородным газам, которые имеют особо устойчивые конфигурации электронов. Условно ковалентная связь обозначается F-F.
Кислород и азот немного отличны:
Здесь для структуры, подобной аргону, требуются по два электрона от каждого атома, и образующаяся двойная связь обозначается как 0=0. Для азота имеем
что обозначается как (тройная связь).
Газы в атмосфере, вода и органические вещества образуются в основном за счет этих типов ковалентных связей (Андруз, 1999).
[7] Для обозначения количества вещества химиками принята единица измерения – моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц сколько содержится атомов в 12 г изотопа углерода 12С. Число структурных единиц, содержащихся в 1 моле вещества – постоянная Авогадро = 6,02 * 1023 моль-1.
[8] Микро (10-6) — микрокомпонент, содержащийся в концентрации 10-6, т. е. ррm (раrtes рго million).
ррm = (мг/м3*Vm)/М (молярная масса);
об%= ррm*10-4.
Аналогично процент 10-2 (рго centum, иначе %) и промилле, например, для солености, 10-3 (рго mille, иначе %о) (Андруз, 1999).
[9] Дисперсные системы — физико-химические системы, состоящие из измельченных частиц (дисперсная фаза), распределенных в окружающей среде (дисперсионная среда) — газе, жидкости или в твердом теле. Частицы дисперсной фазы и дисперсионной среды отделены друг от друга сильно развитой поверхностью раздела между фазами.
Дисперсные системы, состоящие из твердых или жидких частиц, распределенных в газовой фазе, называются аэрозолями. Аэрозоли рассеивают солнечный свет, являются ядрами конденсации для дождевых капель, а также служат поверхностью, на которой протекают гетерогенные газовые реакции.
Размер частиц аэрозолей колеблется в пределах по крайней мере семи порядков — от 1 нм до долей мм. Частицы размером более 10 мкм, видимые невооруженным глазом, считаются грубодисперсными, менее 0,1 мкм — мелкодисперсными', среднедисперсными считаются системы с размерами частиц от 0,1 до 10 мкм. Большинство частиц, находящихся в воздухе, имеет размер не более 0,1 мкм, т.е. относится к высокодисперсным (Андруз, 1999).
[10] Кислотность водных растворов часто описывается с помощью шкалы рН. Кислоты повышают концентрацию водородных ионов (Н+) в растворе и значение рН такого раствора определяется как рН=-lg c (Н+(водн)). Строго говоря, c (Н+(водн) должна означать активность ионов водорода (аН+(водн)), н в данном случае можно представить её подобной концентрации, выраженной в единицах моль*л-1.
Можно записать похожее отношение, определяющее рОН: рОН=-lg c (ОН-(водн)).
Однако величина рН связана с рОН через равновесие, описывающее диссоциацию воды:
Н2О Н+ + ОН-, т.е. Кв=10-14=сН+*с ОН-, таким образом, рН=14-рОН.
Важно отметить, что это логарифмический масштаб и поэтому нельзя усреднять рН растворов (хотя можно усреднить концентрации Н+).
По шкале рН значение 7 считается нейтральным. Существует ряд других важных в отношении окружающей среды значений шкалы (Андруз, 1999).
[11] Кислоты и основания — это важный класс химических соединений, поскольку они осуществляют контроль над реакциями в воде. Традиционно кислотами считались соединения, в результате диссоциации которых в воде появляются ионы водорода:
НСl(водн) Н+(водн) + Сl- (водн)
Определение кислоты, однако, было расширено принятием во внимание переноса электронов и охватывает широкий спектр соединений. Например, борная кислота (Н3ВО3), контролирующая кислотность морской воды, приобретает электроны от гидроксид-иона (ОН-):
Н3ВО3 (водн) + ОН-(водн) В(ОН) -4(водн)
В большинстве случаев достаточно простого определения, и основаниями (или щелочами) можно считать соединения, которые вносят ОН- в водный раствор:
NаОН(водн) Nа+ (водн) + ОН- (водн)
Кислоты и основания вступают в реакции нейтрализации, образуя растворенную соль и воду:
НСl (водн) + NаОН(водн) Сl-(водн) + Nа+ (водн) + Н2O(ж)
Различают два класса кислот и оснований — сильные и слабые. Считается, что соляная кислота (НСl) и гидроксид натрия (NаОН) полностью диссоциируют в растворе с образованием ионов, поэтому их относят к «сильным». Слабые кислоты и основания диссоциируют лишь частично:
НСООН(водн) Н+(водн) + НСОО-(водн)
NН4OН(водн) NН4+ (водн) + ОН-(водн)
Диссоциация — это равновесный процесс, который удобно описать с
помощью констант равновесия для диссоциации кислоты (Ка) и основания (Кb):
с Н+* с НСОО-
Кa = ——————— = 1,77 • 10-1 моль • л-1.
с НСООН
с NН4+* с ОН-
Кb = ——————— = 1,8 • 10-5 моль • л-1(Андруз, 1999).
с NН4OН
[12] Газовые гидраты — типичные решетчатые клатратные соединения, в которых молекулы гидрофобных (или близких к ним) газов включены в полости кристаллического каркаса, построенного посредством водородных связей из молекул воды. Как и все соединения этого типа, газовые гидраты имеют относительно небольшую область термодинамической устойчивости и поэтому чрезвычайно чувствительны к изменениям условий равновесия (Андруз, 1999).
[13] Структура органических молекул (Андруз, 1999).
[14] Радиоактивность – самопроизвольный переход ядер нестабильных атомов в более стабильное состояние. В результате изменений в ядрах атомов выделяется излучение:
α-лучи (ионы гелия);
β-лучи (электроны);
γ-лучи (электромагнитные волны).
Удаление α-частицы из ядра смещает атомный номер в периодической таблице на 2 позиции влево. Массовое число элемента при этом уменьшается на 4 единицы.
При β–распаде массовое число не изменяется. При обычном β-распаде нейтрон превращается в протон с выделением электрона, а атомный номер элемента увеличивается на единицу.
При электронном захвате протон переходит в нейтрон в результате перемещения электрона их К-оболочки атома в ядро. Атомный номер при этом уменьшается на единицу, β-излучение отсутствует, но выделяются Х-лучи.
γ-лучи испускаются при возвращении ядра из возбужденного состояния в обычное состояние.
Все три вида излучения являются ионизирующими и способны наносить повреждения биологическим объектам (лучевая болезнь, мутации, образование злокачественных опухолей). Наибольшей проникающей способностью обладает γ-излучение (Гусакова, 2004).
[15] Период полураспада (Т1/2)– промежуток времени, в течение которого разлагается половина первоначального количества радиоактивного элемента. В конце n-го периода полураспада остается 2-nN0 ядер исходного изотопа. Аналогичное выражение справедливо для массы (m) нераспавшегося изотопа: m=2-n m0, где m0 - исходная масса изотопа (Глинка, 2006).
[16] 1 мЗв эквивалентен разрушению одной молекулы ДНК в одной клетке тела человека. Природно-обусловленное разрушение ДНК имеет скорость порядка 70 млн. год–1 (Зилов, 2006).
[17]В последнее время подход к радиоактивным отходам изменился. Из них стали выделять уран, плутоний, цезий и стронций. А затем оставшийся раствор упаривают и остекловывают. Эту технологию разработали российские ученые, сотрудники ПО «Маяк" и нескольких НИИ: добавляют оксиды фосфора и сильно нагревают. Получаются монолитные блоки из алюмофосфорного стекла, в объеме которого равномерно распределены опасные радионуклиды. Поскольку концентрация трансурановых элементов в радиоактивных исходных отходах невелика, то и в стеклянных кирпичиках их тоже немного, а самих кирпичиков — большое количество.
Ученые из ГЕОХИ им. Вернадского РАН под руководством академика Бориса Мясоедова придумали как уменьшить объем этих стеклянных клеток, а заодно упростить весь процесс. Они предложили объединить два этапа — фракционирования и стеклования.По замыслу авторов, после того как из раствора выделены уран, плутоний, стронций и цезий, раствор следует пропустить через колонки — стеклянные емкости, заполненные специальным носителем. Это мелкие шарики или узкие капилляры из того же самого алюмофосфорного стекла. На него нанесена пленка специального экстрагента — вещества, которое образует с трансурановыми элементами прочные комплексы. В результате все эти радионуклиды остаются внутри колонки, а вытекает из нее безвредная жидкость.Затем остается только прокалить колонки, и получаются все те же стеклянные блоки, в которых навечно замурованы трансурановые элементы. Только концентрация их в каждом кирпичике будет гораздо выше, чем прежде. Значит, все эти опаснейшие радионуклиды вместо огромного бака поместятся всего в нескольких маленьких кубиках. А если их все собрать еще и в контейнер, то хранить их без всякого вреда можно будет очень долго (Радионуклиды в стеклянной…,, 2003).
[18] Биологическая вода - это вода, содержащаяся в живых организмах и растениях, в которых в среднем ее находится 80% (Мешалкин, 2007).
[19] Молекула воды Н2О имеет треугольную форму, где каждый атом водорода (Н) связан с кислородом (О), как показано на рисунке.
Такая форма является следствием расположения электронных орбит, участвующих в связи. Кислород имеет гораздо большую электроотрицательность, чем водород, и притягивает связывающие электроны от атома водорода к себе. Кислород, таким образом, несет частичный отрицательный заряд, обычно обозначаемый как (δ-), а водород — частичный положительный заряд (δ +), создавая диполь (т. е. электрические заряды одинаковой величины и противоположных знаков на небольшом расстоянии друг от друга). В любой момент времени небольшая часть молекул воды полностью диссоциирует, давая ионы Н+ и ОН- согласно реакции
Н2О(ж) Н+ (водн) + ОН- (водн),
для которой константа равновесия равна
К = (а Н+* а ОН-) / аН2О = 10-14 моль2 • л-2
Активность чистой воды по договоренности принята равной единице, и уравнение упрощается до
К=аН+•аОН-
Полярная природа молекулы воды позволяет ионам отдельных молекул воды взаимодействовать с их соседями. Небольшой атом водорода может приближаться и взаимодействовать с кислородом соседней молекулы особенно эффективно. Взаимодействие между, атомом водорода, несущим частичный положительный заряд, и атомами кислорода соседних молекул воды, несущих частичные отрицательные заряды, особенно сильное — согласно стандартам межмолекулярных взаимодействий, хотя и слабее, чем ковалентная связь. Такой тип взаимодействия называют водородными связями. Молекулы в жидкой воде распределены менее беспорядочно, чем в большинстве растворов, из-за водородных связей. Полярность связей делает воду эффективным растворителем для ионов; молекулы воды притягиваются к иону с помощью электростатических сил, образуя во круг него скопление. Более того, соединения, связанные ионными связями, с разделением зарядов между составляющими их ионами легко разрушаются силами притяжения диполя воды. Водородные связи придают воде относительно высокую вязкость и способность к нагреву по сравнению с другими растворителями. Водородные связи позволяют также воде существовать в виде раствора в большом диапазоне температур. Поскольку большинство биологических транспортных систем жидкие, последнее свойство является основополагающим для поддержания жизни (Андруз, 1999).
[20] NаCl является классическим примером твердого ионного вещества: Na. +: С1. Na+: С1-: (точки изображают электроны)/
Теория, лежащая в основе этого поведения, такова, что элементы с электронной структурой, близкой к инертным (благородным) газам, теряют или приобретают электроны, чтобы приобрести стабильную (инертную) структуру. В уравнении натрий (Nа; атомный номер 11) теряет один электрон, достигая структуры неона (Nе; атомный номер 10), тогда как хлор (С1; атомный номер 17) приобретает электрон, добиваясь электронной структуры аргона (Аг; атомный номер 18). Соединение NаCl образуется путем переноса одного электрона от натрия к хлору и образования связи из-за электростатического притяжения с помощью отданного/приобретенного электрона. Соединение электронейтрально.
Твердые кристаллические вещества типа NаCl легко растворимы в таких полярных растворителях, как вода, которые разрушают ионный кристалл до раствора отдельных заряженных ионов.
Положительно заряженные атомы типа Na+ известны как катионы, тогда как отрицательно заряженные ионы типа С1- называют анионами (Андруз, 1999).
[21] Активная концентрация ионов, или активность, становится важным понятием в концентрированных и сложных растворах типа морской воды. Ионы в концентрированном растворе находятся на достаточно близком расстоянии друг от друга. Элетростатические взаимодействия снижают эффективные концетрации способных участвовать в реакции ионов. Чтобы точно предсказать протекание химических реакций в концентрированных растворах, надо принимать в расчет уменьшение эффективной концентрации, что делается с помощью коэффициента активности (γ): а=с* γ, где а-активность (Андруз, 1999).
[22] Концентрация раствора электролита может быть выражена в виде ионной силы (I), определяемой как
I=1/2Σсiz2i
где с, — концентрация ионов (i) в моль • л-1, zi — заряд иона (i).
Ионная сила лучше в качестве меры концентрации сложного раствора электролита, чем простая сумма молярных концентраций, поскольку она учитывает влияние зарядов разновалентных ионов.
Пресные воды обычно имеют значения ионной силы между 10-3 и 10-4 моль • л-1, тогда как морская вода имеет довольно постоянную ионную силу, равную 0,7 моль • л-1(Андруз, 1999).
[23] В физико-химическом понимании коагуляция - процесс соединения коллоидныхчастиц друг с другом в более крупные частицы, которые становятся седиментационно-неустойчивыми и оседают на дно. Коллоидные растворы коагулируют при введении в них электролитов или коллоидов противоположного знака, под действием физических факторов, таких, например, как изменение температуры (Мешалкин, 2007).
[24] В разработку и освоение на отечественных сооружениях различных методов, аппаратов, оборудования и сооружений для уплотнения, сгущения, аэробной стабилизации, механического обезвоживания, термической обработки и утилизации осадков городских и производственных сточных вод большой вклад внесли сотрудники лаборатории обработки осадков НИИ ВОДГЕО (Методические рекомендации…, 2002).
[25] Взвешенные вещества – это вещества, которые остаются на фильтре при использовании того или иного способа фильтрования (Хаммер, 1979).
[26] Септик-комбинированное сооружение, в котором происходит осветление сточной воды и сбраживание выпавшего осадка (Яков
|
|
|


