 |
Разделение белковых фракций методом высаливания
|
|
|
|
Лабораторная работа №5
Тема:
РЕАКЦИИ ОБНАРУЖЕНИЯ АМИНОКИСЛОТ, БЕЛКОВ
И ИХ ВЫЯВЛЕНИЕ В БИОЛОГИЧЕСКИХ СРЕДАХ
Цель: Отработать умения экспериментально исследовать свойства аминокислот и белков.
Опыт № 1
Нингидриновая проба
Реакция характерна для α-аминокислот и их остатков. Растворы α- аминокислот и белков при нагревании с нингидрином приобретают фиолетовое окрашивание.
Методика эксперимента
В одну из двух пробирок прилить 3 - 5 капель 1 % раствора яичного белка, в другую
3 – 5 капель 0,1 % раствора глицина. В каждую пробирку наливают по 2 – 3 капли 0,1 % водного раствора нингидрина. Содержимое пробирок осторожно нагреть. Описать наблюдения, сделать выводы.

Наблюдения__________________________________________
Выводы___ ___________________________________________
Опыт 2
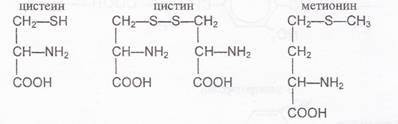
Обнаружение серосодержащих α -аминокислот
(реакция Фоля)
Реакция Фоля позволяет обнаружить в белке аминокислоты, содержащие слабосвязанную серу, например:
Методика эксперимента
В пробирку поместить 5 – 10 капель раствора яичного белка и вдвое больший объем 10 % раствора гидроксида натрия. Содержимое пробирки перемешать, нагреть до кипения (1 – 2 мин). К полученному щелочному раствору добавить 3 – 5 капель 10 % ацетата свинца и вновь прокипятить. Описать наблюдения.
Химизм процесса
При кипячении белка со щелочью α-содержащие аминокислоты образуют сульфид натрия.

Интенсивность окраски зависит от количества серосодержащих аминокислот в белке и от концентрации белка в растворе.
Наблюдения__________________________________________
Выводы___ ___________________________________________
Опыт №3
Амфотерные свойства α-аминокислот
Амфотерность α-аминокислот обусловлена наличием в молекулах карбоксильной и аминогрупп, за счет которых они образуют цвиттер-ион:
|
|
|


Методика эксперимента
а) В одну пробирку поместить 3 – 5 капель 1 % раствора α-аланина и добавить по каплям
0,1 % раствор хлороводородной кислоты, подкрашенной конго.
б) Во вторую пробирку поместить 3 – 5 капель 1 % раствора α -аланина и по каплям добавить 0,1 % раствора гидроксида натрия, подкрашенного фенолфталеином. Запасать наблюдения.
Химизм процесса

Наблюдения__________________________________________
Выводы___ ___________________________________________
Опыт №4
Реакция глицина с формальдегидом
Реакция позволяет защитить аминогруппу и используется для количественного определения карбоксильных групп в α-аминокислотах путем кислотно-основного титрования.
Методика эксперимента
В пробирку поместить 5 капель 1 % раствора глицина и добавить 1 – 2 капли метилового красного и 3-5 капель раствора формалина. Наблюдается изменение окраски. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют 3 – 5 капель формалина. При этом происходит изменение окраски.
Химизм процесса

Блокируя аминогруппу формальдегид одновременно освобождает карбоксильную группу, которую далее можно анализировать методом титрования щелочью.
Наблюдения__________________________________________
Выводы___ ___________________________________________
Опыт №5
Обнаружение пептидной связи
И образование комплексной соли глицина
Пептидную или белковую макромолекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающей с образованием пептидной (амидной) связи между мономерными звеньями.
Методика эксперимента
В две пробирки прилить 3 – 5 капель 1 % раствора сульфата меди, добавить по каплям 10 % раствор гидроксида натрия до образования осадка. Далее в одну из двух пробирок приливают по каплям 1 % раствор глицина, а во вторую – раствор белка до растворения.
|
|
|

Наблюдения__________________________________________
Выводы___ ___________________________________________
Опыт №6
Осаждение белка концентрированными
Минеральными кислотами (проба Геллера)
Методика эксперимента
В пробирку наливают 10 – 15 капель концентрированной азотной кислоты и, наклонив пробирку под углом 45°, осторожно, по стенке пробирки, спускают из пипетки равный объем 1 % раствора белка. На границе двух слоев жидкости образуется осадок белка в виде пленки.
Сущность процесса
Белок при взаимодействии с концентрированной минеральной кислотой выпадает в осадок, вследствие нарушения вторичной, третичной и четвертичной структуры. Этот процесс называется денатурацией. Осаждение белка происходит под действием органических растворителей, при кипячении.
Наблюдения__________________________________________
Выводы___ ___________________________________________
Опыт №7
Разделение белковых фракций методом высаливания
Осаждение белка методом высаливания при различной степени насыщения и различном водородном показателе (рН) раствора используют для разделения белковых фракций, при получении очищенных ферментативных и гормональных препаратов, а также для получения белков в кристаллическом состоянии.
Методика эксперимента
К 10 – 15 каплям соленого раствора яичного белка приливают равный объем насыщенного раствора сернокислого аммония (полунасыщенного). Выпадает осадок яичного глобулина. Через 5 минут осадок отфильтровывают и к фильтрату добавляют мелко истолченный порошок сернокислого аммония до прекращения растворения соли, т.е. до полного насыщения.
Сущность процесса
Образуется осадок яичного альбумина, который всплывает наверх вследствие высокой плотности жидкости. При высаливании белок обычно не теряет присущих ему физико-химических и биологических свойств.
Наблюдения__________________________________________
Выводы___ ___________________________________________
Опыт №8
|
|
|


