 |
Классификация химических реакций
|
|
|
|
Физическая химия неравновесных процессов
(курс лекций)
Екатеринбург
Содержание
Введение 4
I. Химическая кинетика 5
Основные понятия химической кинетики 5
1.1. Классификация химических реакций 5
1.2. Элементарные химические реакции 6
1.3. Скорость химических реакций 6
1.4. Кинетические кривые и уравнения 7
1.5. Молекулярность и порядок реакции 8
Элементарный акт химического превращения 9
2.1. Теория переходного состояния или активированного
комплекса 9
2.2. Односторонние (необратимые) реакции первого порядка 11
2.3. Односторонние реакции второго порядка 13
2.4. Односторонние реакции n-го порядка 14
2.5. Методы определения порядка реакции 15
Сложные химические реакции 17
3.1. Обратимые (двусторонние) химические реакции 18
3.2. Параллельные химические реакции 19
3.3. Односторонние последовательные реакции 21
Зависимость скорости химической реакции от
Температуры 23
Гетерогенные химические реакции 25
Каталитические реакции (катализ) 29
6.1. Свойства катализаторов 29
6.2. Каталитическая активность и избирательность 32
6.3. Кислотно-основной катализ 33
6.4. Гетерогенный катализ. Теории гетерогенного катализа 36
II. Электрохимия 41
Общие понятие об электрохимических системах 41
1.1. Предмет электрохимии 41
1.2. Проводники электрических зарядов 41
1.3. Электролиз. Законы Фарадея. 41
Растворы электролитов, их свойства 43
2.1. Сильные и слабые электролиты 43
2.2. Электролитическая диссоциация в растворе 44
2.3. Механизм переноса тока в растворах электролитов.
Числа переноса 47
2.4. Удельная и эквивалентная электрические проводимости
растворов электролитов 48
|
|
|
2.5. Молярная электрическая проводимость 50
2.6. Молярная электрическая проводимость ионов гидроксония
и гидроксида 51
2.7. Влияние природы растворителя на предельную
подвижность ионов 53
2.8. Зависимость молярной электропроводимости от
температуры 54
Ионные равновесия в растворах электролитов 56
3.1. Термодинамическая константа диссоциации
растворов электролитов 56
3.2. Диссоциация воды. Ионное произведение воды 59
Электродные процессы и электродвижущие силы 61
4.1. ЭДС электрохимической системы, электродный потенциал 61
4.2. Строение двойного электрического слоя на границе
раствор – металл 62
4.3. Устройство и изображение гальванического элемента 63
4.4. Компенсационный метод измерения ЭДС 65
4.5. Термодинамика гальванического элемента 65
4.6. Вывод уравнения Нернста для расчёта ЭДС
гальванического элемента 67
Введение
Основными задачами учебной дисциплины «Физическая химия неравновесных процессов» является изучение и объяснение закономерностей, определяющих временные характеристики химических процессов, скорость их протекания, влияние на них параметров окружающей среды, условия получения максимального выхода продукта. Эта дисциплин формирует творческое инженерное мышление студентов, стремится к количественному описанию химических процессов, используя такие фундаментальные методы исследования как термодинамический, квантово – химический, статистический, поэтому для успешного усвоения кинетических закономерностей химических превращений студент должен владеть основами физики и высшей математики, а также иметь твердые знания по неорганической и органической химии.
Знание физико – химических закономерностей протекания химических реакций во времени открывает перед инженером широкие возможности для понимания функционирования экологических систем, разработки новых технологических процессов, удовлетворяющих современным требованиям экологической безопасности, для разработки методов и средств, необходимых для создания автоматизированных систем мониторинга окружающей среды.
|
|
|
Преподавание физической химии неравновесных процессов имеет цель дать студенту тот фундамент, с помощью которого можно провести количественный анализ любого физико-химического процесса.
I. Химическая кинетика
Основные понятия химической кинетики
Химическая кинетика – это наука, изучающая протекание химической реакции или физико – химических процессов во времени, это раздел физической химии, в котором изучается зависимость скорости химической реакции от концентрации реагентов, температуры, свойств среды, излучения и других факторов.
Химическая кинетика позволяет рассчитать время заданной степени превращения вещества и найти наиболее эффективные факторы воздействия на скорость химической реакции.
Классификация химических реакций
С точки зрения кинетики существует несколько принципов классификации химических реакций:
1) по агрегатному состоянию участников реакции все реакции делятся на гомогенные и гетерогенные.
Гомогенные реакции, когда все реактанты находятся в одной фазе. Они бывают:
а) газофазные
б) жидкофазные
в) твердофазные
Гетерогенные реакции, когда участники реакции находятся в разных фазах; реакция протекает на границе раздела фаз
2) по специфике элементарного акта
а) каталитические
б) некаталитические
в) фотохимические
г) электрохимические
д) цепные
3) по числу стадий
а) простые (1 стадия)
б) сложные
4) по обратимости реакций
а) обратимые (двусторонние)
б) необратимые
Реакция считается необратимой, если:
а) в результате реакции образуется газ
HCOOH → H2O + CO2 ↑
б) образуется труднорастворимое соединение
AgNO3 + KJ → AgJ↓ + KNO3
в) образуется малодиссоциируемое соединение
HNO3 + NaOH → NaNO3 + H2O
г) выделяется большое количество тепла
3Fe3O4 + 8Al → 4Al2O3 + 9Fe + ∆H↑
1.2. Элементарные химические реакции
Скорость химических реакций зависит от пути прохождения реакции. Этот путь может быть представлен в виде суммы элементарных химических реакций.
Элементарная реакция – это односторонний процесс превращения одних компонентов в другие. Она является совокупностью однотипных элементарных актов химического превращения. Большинство химических реакций не являются элементарными; они включают в себя несколько элементарных стадий – сложные реакции.
|
|
|
Механизм реакции – это совокупность элементарных стадий.
Реактант – участник химической реакции.
dρnk – бесконечно малое изменение числа молей компонента k в элементарной реакции ρ
Если dρnk > 0 – продукт реакции
dρnk < 0 – исходное вещество
dρnk = 0 – индифферентное вещество
1.3. Скорость химической реакции
Скорость химической реакции – это число однотипных элементарных актов химического превращения, совершающихся в единицу времени в единице объема или на единице поверхности.
Рассмотрим реакцию: 
t = 0 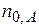


 - исходные числа молей
- исходные числа молей
t ≠ 0 nA nB nC nD - текущие числа молей
(кси) ξ – глубина протекания реакций
ξ 

ξ  (1.1)
(1.1)
d ξ  (1.2)
(1.2)
Под скоростью химической реакции понимается производная по времени от глубины протекания реакции.
Wp  (1.3)
(1.3)
Wp  (1.4)
(1.4)
x – плотность глубины реакции, x = 
V – объем реакционной системы
x =  =
=  (1.5)
(1.5)
Wp(V) =  - плотность скорости реакции
- плотность скорости реакции
тогда Wp(V) =  (1.6)
(1.6)
или Wp(V) =  (1.7)
(1.7)
Скорость химической реакции можно определить по изменению концентрации одного из компонентов реакции
W(V) =  (1.8)
(1.8)
По мере протекания реакции ее скорость будет уменьшаться
Основной постулат Бекетова – Гульдберга – Вааги:
Скорость химической реакции пропорциональна концентрации исходных веществ в степенях, равных их стехиометрическим коэффициентам
 (1.9)
(1.9)
где k – константа скорости реакции
если  , то количественно
, то количественно 
k определяется природой реакции, T и присутствием катализаторов; K называют удельной скоростью. Этот постулат справедлив для простых одностадийных реакций.
|
|
|


