 |
Решение Задачи 9-1 (автор: Ильин М. А.)
|
|
|
|
1. Обозначим состав хлорида А в виде X Cl n, а атомную массу металла X – x а. е. м. Тогда:
 Перебирая целочисленные значения n от 1 до 8, приходим к единственному разумному варианту X – Al, а А – AlCl3 (M = 133,4 г/моль). Учитывая, что стехиометрический состав хлорида Е – Y Cl3, находим атомную массу металла Y:
Перебирая целочисленные значения n от 1 до 8, приходим к единственному разумному варианту X – Al, а А – AlCl3 (M = 133,4 г/моль). Учитывая, что стехиометрический состав хлорида Е – Y Cl3, находим атомную массу металла Y:
(133,4 × 1,187) – (35,45 × 3) = 158,3 – 106,4 = 51,9 а. е. м.
Таким образом, Y – Cr.
2. При взаимодействии избытка концентрированного раствора щёлочи с хлоридом алюминия в зависимости от pH возможно образование гидроксокомплексов различного состава (реакция 2). Гидроксоалюминаты устойчивы лишь в водных растворах, при упаривании их водных растворов и последующем прокаливании (800 °С) происходит образование метаалюминатов (реакция 3). При пропускании избытка углекислого газа через раствор гидроксоалюминатов выпадает студенистый осадок гидроксида алюминия переменного состава (реакция 4), который также образуется при добавлении избытка водного раствора аммиака к раствору хлорида алюминия. При взаимодействии гидроксида алюминия с плавиковой кислотой в присутствии фторида натрия образуется соединение, содержащее устойчивый гексафтороалюминат‑ион (реакция 5).
При добавлении водного раствора сульфида натрия к раствору хлорида хрома происходит необратимый гидролиз, в результате чего образуется осадок гидроксида хрома (III) (реакция 8). При добавлении избытка раствора соляной кислоты и металлического хрома в инертной атмосфере образуется раствор хлорида хрома (II) (реакция 9). Концентрированный раствор пероксида водорода в щелочной среде (KOH) приводит к окислению Cr(III), в результате чего образуется хромат калия (реакция 10). Хромат‑ионы устойчивы лишь в нейтральной и щелочной среде, при подкислении раствором сильной минеральной кислоты (H2SO4 разб.) они довольно быстро превращаются в дихромат‑ионы (реакция 11), которые в кислой среде проявляют довольно сильные окислительные свойства (реакция 12). Таким образом, формулы соединений А–К:
|
|
|
А – AlCl3; Е – CrCl3;
Б – Na3[Al(OH)6] (Na[Al(OH)4], Na[Al(H2O)2(OH)4]); Ж – Cr(OH)3;
В – NaAlO2; З – CrCl2;
Г – Al(OH)3; И – K2CrO4;
Д – Na3[AlF6]; К – K2Cr2O7.
Уравнения реакций (1 – 12):
(1) 2Al + 3Cl2 ® 2AlCl3;
(2) AlCl3 + 6NaOH изб. конц. ® Na3[Al(OH)6] + 3NaCl,
(AlCl3 + 4NaOH изб. конц. ® Na[Al(OH)4] + 3NaCl),
(AlCl3 + 4NaOH изб. конц. + 2H2O ® Na[Al(H2O)2(OH)4] + 3NaCl);
(3) Na3[Al(OH)6] 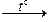 NaAlO2 + 2NaOH + 2H2O,
NaAlO2 + 2NaOH + 2H2O,
(Na[Al(OH)4] 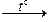 NaAlO2 + 2H2O),
NaAlO2 + 2H2O),
(Na[Al(H2O)2(OH)4] 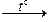 NaAlO2 + 4H2O);
NaAlO2 + 4H2O);
(4) Na3[Al(OH)6] + 3CO2 изб. ® Al(OH)3¯ + 3NaHCO3,
(Na[Al(OH)4] + CO2 изб. ® Al(OH)3¯ + NaHCO3),
(Na[Al(H2O)2(OH)4] + CO2 изб. ® Al(OH)3¯ + NaHCO3 + 2H2O);
(5) Al(OH)3 + 3HF конц. + 3NaF ® Na3[AlF6]¯ + 3H2O;
(6) AlCl3 + 3NH3 изб. + 3H2O ® Al(OH)3¯ + 3NH4Cl;
(7) 2Cr + 3Cl2 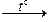 2CrCl3;
2CrCl3;
(8) 2CrCl3 + 3Na2S + 6H2O ® 2Cr(OH)3¯ + 6NaCl + 3H2S;
(9) 2CrCl3 + 2HCl + 2Cr  4CrCl2 + H2,
4CrCl2 + H2,
(2CrCl3 + Cr  3CrCl2);
3CrCl2);
(10) 2Cr(OH)3 + 3H2O2 конц. + 4KOH ® 2K2CrO4 + 8H2O;
(11) 2K2CrO4 + H2SO4 разб. ® K2Cr2O7 + K2SO4 + H2O;
(12) 2K2CrO4 тв . + 16HCl конц. 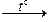 2CrCl3 + 3Cl2 + 4KCl + 8H2O.
2CrCl3 + 3Cl2 + 4KCl + 8H2O.
3. Тривиальное (оно же минералогическое) название соединения Д – криолит. Для получения алюминия используется смесь Al2O3 (~10–15 %) и Na3[AlF6] (~85–90 %). Криолит позволяет существенно понизить температуру проведения электролиза (t пл.(Al2O3) ~ 2053 °C!), а также значительно увеличить электропроводность расплава.
4. Водный раствор хлорида хрома (II) будет быстро окисляться кислородом воздуха до соединений Cr(III):
4CrCl2 + O2 + 2H2O ® 4Cr(OH)Cl2.
или (в присутствии HCl): 4CrCl2 + O2 + 4HCl ® 4CrCl3 + 2H2O
Система оценивания:
| 1. | Металлы X и Y (с расчётами; без расчётов – 0,5 балла) | 1 балл |
| 2. | Формулы соединений А–Кпо 0,5 балла; Уравнения реакций 1–12 по 1 баллу | 17 баллов |
| 3. | Тривиальное (минералогическое) название Д – 0,5 балла; Добавление Д (любой из вариантов в решении) – 0,5 балла | 1 балл |
| 4. | Уравнение реакции окисления раствора З на воздухе | 1 балл |
| ИТОГО: | 20 баллов |
Задача 9-2. Элемент Х мало распространён в природе. Чаще всего его соединения сопутствуют минералам, содержащим элемент Y, находящийся с Х в одной подгруппе. Элемент Y встречается в земной коре и в виде простого вещества.
|
|
|
При действии разбавленной азотной кислоты на простое вещество А, образованное элементом Х, получается кислота 1, содержащая 61,2 % Х по массе (реакция 1). При действии на кислоту 1 30%-ным раствором пероксида водорода образуется кислота 2 (реакция 2). О кислоте 2 известно, что она является сильным окислителем и способна растворять золото. Золото переходит в соединение, содержащее ион Au(3+), и анион кислоты 2, а в реакции не образуются газообразные продукты (реакция 3).
1. Установите, о каких элементах X, Y идёт речь. Ответ обоснуйте.
Про Y дополнительно известно, что он может образовать кислоты, аналогичные по составу кислоте 1 и кислоте 2.
2. Определите кислоту 1 и кислоту 2. Ответ подтвердите расчётом.
3. Напишите уравнения реакций 1–3.
4. В честь какого небесного тела назван элемент Х?
Напишите уравнение реакции простого вещества А при сплавлении с алюминием и гидроксидом натрия (реакция 4). Установите формулу бинарного продукта реакции соединения Б, содержащего в структуре цепочки Х4, массовая доля Х в Б составляет 87,3 %.
|
|
|


