 |
Решение Задачи 11-2 (автор: Беззубов С. И.)
|
|
|
|
1. Водным аммиаком можно осадить гидроксиды металлов, проявляющие слабые по сравнению с аммиаком основные свойства, при условии, что соответствующий металл не образует аммиачные комплексы. Если А – гидроксид элемента X бурого цвета, тогда соль B – сульфат, так как она получается при действии серной кислоты на этот гидроксид. Сульфат B проявляет окислительные свойства по отношению к сильным восстановителям (SO2, иодид, сульфид ионы). Значит, X – переходный элемент. (Это следует из того, что соль С – тоже сульфат, так как растворимые в воде сульфиты дают только непереходные металлы.) То есть X образует сульфаты в двух разных степенях окисления, причём водные растворы B окрашены в характерный для этой степени окисления X жёлтый цвет. Смешанный сульфат D – по всей вероятности, квасцы, которые дают только трёхзарядные катионы, значит В содержит X +3. Учитывая все эти соображения, элементом X может быть только железо. Кроме того, щелочное окисление хлором гидроксида железа (III) приводит именно к красно-фиолетовым растворам, содержащим анионы феррата (IV). Хром и марганец в таких условиях давали бы, соответственно, жёлтые растворы хромата (IV) CrO42− и зелёные манганата (IV) MnO42−. Впрочем, и в низких степенях окисления в водных растворах Cr(III) и Mn(III) имеют отличную от жёлтой окраску.
Бурый гидроксид железа (III), образующийся непосредственно после осаждения, например, аммиаком, называется также ферригидритом. Вокруг его структуры до сих пор идут споры в связи с чрезвычайно малым размером образуемых частиц (< 10 нм). Попытки вырастить более крупные частицы, к сожалению, приводят к образованию более стабильных модификаций гидроксида железа (III). Ферригидрит входит в состав белкового комплекса ферритина, имеющего колоссальное физиологическое значение для организма животных и человека.
|
|
|
2. Таким образом, описанные превращения касаются элемента железа.
X – Fe
A – Fe2O3∙3H2O (или Fe2O3∙ x H2O, или Fe(OH)3)
B – Fe2(SO4)3
C – FeSO4
D – 2KFe(SO4)2∙12H2O
E – K2FeO4 (принимается любой феррат (VI), в том числе и в ионной форме FeO42−)
F – BaFeO4
Расчёт молярной массы феррата (VI) бария:
Молярная масса удушливого жёлто-зелёного газа M r(газа) = 22,4∙3,17 = 71 (г/моль) – это хлор. ν (Cl2) = 0,179/22,4 = 0,0080 (моль).
Используя уравнение реакции 9) (см. пункт 3), ν (феррата бария) = 0,008∙2/3 (моль).
M r(феррата бария) = 1,37∙3/0.008/2 = 257 (г/моль). Молярная масса соответствует формуле BaFeO4.
Определение формулы кристаллогидрата C:
Формула кристаллогидрата сульфата железа (II) – FeSO4∙ y H2O. Найдём y. Mr(FeSO4∙ y H2O) = 56 + 96 + y ∙18 = 152 + 18 y (г/моль).
ω(H2O) = 18 y /(152 + 18 y) = 0,453. Отсюда y = 7. Формула FeSO4∙7H2O
Определение формулы кристаллогидрата F:
Смешанный сульфат содержит ионы железа (III), калия, сульфат и молекулы воды. Из условия электронейтральности молекулы соли формула – KFe(SO4)2∙ z H2O. Найдём z. M r(KFe(SO4)2∙ z H2O) = 39 + 56 + 2∙96 + z ∙18 = 287 + 18 z (г/моль).
ω(H2O) = 18 z /(287 + 18 z) = 0,429. Отсюда z = 12. Формула KFe(SO4)2∙12H2O
Проверка массовых долей железа:
кристаллогидрат C: ω(Fe) = 56/278 = 0,201
F: ω(Fe) = 56/503 = 0,111.
Всё сходится с условием задачи.
3. Уравнения реакций (засчитывается также Fe2O3∙ x H2O или Fe(OH)3):
1) Fe2(SO4)3 + 6NH3∙H2O = Fe2O3∙3H2O↓ + 3(NH4)2SO4
2) Fe2O3∙3H2O + 3H2SO4 = Fe2(SO4)3 + 6H2O
3) Fe2(SO4)3 + SO2 + 2H2O = 2FeSO4 + 2H2SO4
4) Fe2(SO4)3 + 2KI 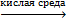 2FeSO4 + K2SO4 + I2↓
2FeSO4 + K2SO4 + I2↓
5) Fe2(SO4)3 + H2S = 2FeSO4 + H2SO4 + S↓
6) Fe2(SO4)3 + K2SO4 + 24H2O = 2KFe(SO4)2∙12H2O↓
7) Fe2O3∙3H2O + 3Cl2 + 10KOH = 2K2FeO4 + 6KCl + 8H2O
8) K2FeO4 + Ba(OH)2 = BaFeO4↓ + 2KOH
9) 2BaFeO4+ 16HCl = 2FeCl3 + 3Cl2↑ + 2 BaCl2 + 8H2O
4. При растворении квасцов в воде происходит гидролиз по катиону. В действительности, Fe(OH)3 начинает осаждаться уже при рН 1, поэтому в водных растворах всех солей железа (III) в высокой концентрации представлены различные продукты гидролиза, которые и обуславливают жёлтую окраску. В данном пункте засчитывается уравнение реакции гидролиза Fe3+ по любой ступени, например:
|
|
|
Fe3+ + H2O  FeOH2+ + H+,
FeOH2+ + H+,
FeOH2+ + H2O  Fe(OH)2+ + H+,
Fe(OH)2+ + H+,
Fe(OH)2+ + H2O  Fe(OH)3↓ + H+,
Fe(OH)3↓ + H+,
или реакция в молекулярной форме:
2KFe(SO4)2∙12H2O  Fe2O3∙3H2O↓ + K2SO4 + 3H2SO4 + 18H2O
Fe2O3∙3H2O↓ + K2SO4 + 3H2SO4 + 18H2O
5. Речь идёт о превращении ферригидрита при 70 °C в щелочном растворе в более стабильную модификацию: гётит (G, Göthite), что сопровождается потерей части воды:
Fe2O3∙3H2O  2FeOOH + 2H2O.
2FeOOH + 2H2O.
При более высокой температуре идёт полная дегидратация:
Fe2O3∙3H2O  Fe2O3 + 3H2O,
Fe2O3 + 3H2O,
с образованием оксида железа (III), наиболее известный минерал которого гематит (H, Hematite).
Проверка массовых долей железа:
G: ω(Fe) = 56/89 = 0,629
H: ω(Fe) = 112/160 = 0,700.
Всё сходится с условием задачи.
Система оценивания:
| 1. | За обоснованное определение железа 2 балла, установление металла без пояснений – 1 балл; | 2 балла |
| 2. | За правильные формулы веществ A–F по 0,5 балла, за расчёт состава кристаллогидратов C и D по 1 баллу; | 5 баллов |
| 3. | За правильные уравнения реакций 1–9 по 1 баллу; | 9 баллов |
| 4. | За указание причин жёлтой окраски с уравнением гидролиза 2 балла, без уравнения – 1 балл; | 2 балла |
| 5. | За правильные формулы G и H по 0,5 балла, за уравнения реакций образования гётита и Fe2O3 по 0,5 балла; | 2 балла |
| ИТОГО: | 20 баллов |
Задача 11-3. Для промышленного получения вещества X в России используются два основных способа.
Способ 1: реакция вещества A (85,6 % C, 14,4 % H по массе) с водой в паровой фазе при 300 °C, катализатор – нанесённая на силикагель фосфорная кислота (стандартная энтальпия реакции ΔH° = −43.7 кДж в расчёте на 1 моль вещества A).
Способ 2: гидролиз распространённого в природе вещества B (44,5 % C, 6,2 % H, 49,3 % O) под действием водного раствора серной кислоты при 250 °C под давлением до вещества C (40,0 % C, 6.7 % H, 53,3 % O; ΔH° = −26,2 кДж/моль на 1 моль вещества C), затем ферментативное разложение вещества C в подкисленном водном растворе (ΔH° = −67,7 кДж/моль на 1 моль вещества C).
Энтальпия образования из элементов при стандартных условиях:
вещества A ΔfH° = 1,87 кДж/г,
вещества B ΔfH° = −5,93 кДж/г,
вещества C ΔfH° = −7,07 кДж/г.
1. Определите брутто-формулы веществ X, A−C, напишите их названия. Запишите уравнения упомянутых реакций.
|
|
|
2. Вычислите стандартную энтальпию образования вещества X. Приведите расчёты.
3. Вещество A всегда содержит примесь ближайшего гомолога. Какая основная примесь будет присутствовать в продукте синтеза по методу 1?
4. Какой из методов более выгоден экономически в России и Европе, если пренебрегать энергетическими затратами, неколичественным выходом и стоимостью катализаторов, а рыночная цена 1 тонны вещества A в России составляет 15 000 рублей, в Европе 1 000 евро; вещества B в России 40 000 рублей, в Европе 600 евро. Подтвердите ответ расчётом.
5. Ещё один распространённый способ получения вещества X основан на гидролизе изомера вещества B с образованием на первой стадии того же самого продукта C. Как называется этот изомер? Требуются ли для его гидролиза более жёсткие условия, чем в случае B?
Вещество X может использоваться в качестве альтернативного экологически чистого топлива (хотя и требует несколько модифицированные версии двигателей).
6. При какой цене за тонну использование X станет экономически выгодно по сравнению с бензином, если себестоимость бензина АИ-95 в России составляет 8 рублей за литр, а теплота сгорания 33 МДж/л? Подтвердите ответ расчётом.
Решение Задачи 11-3 (автор: Седов И. А.):
1. Исходя из массовых долей элементов, определим простейшие формулы веществ:
A: (85.6 / 12): (14.4 / 1) = 1: 2, (CH2) n;
B: (44.6 / 12): (6.2 / 1): (49.3 / 16) = 6: 10: 5, (C6H10O5) n;
C: (40 / 12): (6.7 / 1): (53.3 / 16) = 1: 2: 1, (CH2O) n.
Формула A соответствует циклоалканам и алкенам. Из последних при реакции с водой получаются спирты. Формулы B и C соответствуют углеводам, причём формула B – либо продуктам дегидратации гексоз, либо полисахаридам (C6H10O5) n. С учётом распространённости в природе и относительной сложности гидролиза можно сделать вывод, что это целлюлоза (а изомер из пункта 5 – крахмал). Тогда C – глюкоза, C6H12O6, которая, как известно, под действием ферментов превращается в этиловый спирт C2H5OH (X). Значит, A – этилен C2H4.
C2H4 + H2O = C2H5OH
(C6H10O5) n + n H2O = n C6H12O6
C6H12O6 = 2 C2H5OH + 2 CO2
2. Найдём стандартные мольные энтальпии образования веществ A – C:
|
|
|
A Δ H ° (C2H4) = 1.87 · 28 = 52 кДж/моль;
B Δ H ° (C6H10O5) = –5.93 · 162 = –961 кДж/моль;
C Δ H ° (C6H12O6) = –7.07 · 180 = –1273 кДж/моль.
Для удобства обозначим Δ H ° (C2H5OH) = x, Δ H ° (H2O) = y, Δ H ° (CO2) = z. Тогда:
x – 52 – y = –43.7;
– 1273 + 961 – y = –26.2;
2 x + 2 z + 1273 = –67.7.
Решая эту систему, находим Δ H ° (C2H5OH) = x = –278 кДж/моль.
Кроме того, для дальнейших расчётов нам понадобятся полученные значения y = –286 кДж/моль, z = –393 кДж/моль.
3. Гомолог – пропен C3H6, из которого получается пропанол-2 (CH3)2CHOH. (Пропанол-1 не оценивается).
4. Исходя из приведённых цифр, себестоимость производства 1 тонны этанола из этилена в России составляет 15000 · M (C2H4) / M (C2H5OH) = 9130 рублей, в Европе 1000 · M (C2H4) / M (C2H5OH) = 609 евро; из целлюлозы в России 40000 · M (C6H10O5) / M (C6H12O6) = 36000 рублей, в Европе 600 · M (C6H10O5) / M (C6H12O6) = 540 евро. В Европе выгоднее производство спирта из целлюлозы, а в России из этилена.
(Однако ещё более выгодно, с учётом приведённых выше цен, ничего не производить, а продавать этилен в Европу.)
5. Крахмал также является полимером глюкозы, но с α-гликозидными связями. Гидролиз крахмала протекает в гораздо более мягких условиях.
6. Рассчитаем теплоту сгорания 1 литра этанола по реакции
C2H5OH + 3O2 = 2CO2 + 3H2O
Стандартная энтальпия сгорания равна –2·393 − 3·286 + 278 = −1366 кДж/моль, или 29.7 МДж/кг. Такое количество энергии выделяет 29.7/33 = 0.9 л бензина. Чтобы конкурировать с ним, цена этанола должна быть не более 0.9·8 = 7.2 рубля за кг или 7200 рублей за тонну.
Система оценивания:
| 1. | Верные формулы А–С по 1.5 балла; за названия по 0.5 балла; | 8 баллов |
| 2. | Расчёт стандартной энтальпии образования вещества X – 4 балла (за верную систему уравнений при неверном ответе – 2 балла); | 4 балла |
| 3. | Верная формула примеси; | 1 балл |
| 4. | Выбор более выгодного метода для России и Европы по 1 баллу (вывод без расчётов – 0 баллов); | 2 балла |
| 5. | Название изомера вещества В – 1 балл; указание на более мягкие условия – 1 балл; | 2 балла |
| 6. | Расчёт энтальпии сгорания 2 балла; определение максимальной цены – 1 балл. | 3 балла |
| ИТОГО: | 20 баллов |
Задача 11-4. Тетрагидридоалюминат лития (Li[AlH4], алюмогидрид лития) часто используется в органическом синтезе в качестве эффективного восстановителя самых разнообразных органических соединений. В лабораторной практике это соединение можно получить при взаимодействии безводного хлорида алюминия с гидридом лития в абсолютном (безводном) диэтиловом эфире.
1. Почему получение Li[AlH4] важно осуществлять в безводных условиях? Поясните свой ответ с помощью соответствующего уравнения реакции.
2. Можно ли получить безводный AlCl3 а) при взаимодействии металлического алюминия с концентрированной соляной кислотой; б) при взаимодействии металлического алюминия с хлором; в) при прокаливании кристаллогидрата AlCl3·6H2O на воздухе? Дайте необходимые пояснения и напишите уравнения упомянутых в пунктах а–в реакций.
|
|
|
На приведённой ниже схеме превращений соединения I–VII получены с помощью восстановления алюмогидридом лития соединений А–З, принадлежащих к восьми различным классам органических соединений.

Примечание: R = C6H5CO –; ДМФА – диметилформамид (растворитель)
3. Напишите структурные формулы органических соединений А–З и I–VII.
4. Напишите уравнение реакции (со всеми продуктами и стехиометрическими коэффициентами) окисления пропена перманганатом калия в сернокислой среде (получение соединения Е).
|
|
|


