 |
П. 6. Мезомерный эффект заместителей. Теория резонанса.
|
|
|
|
Какой же вывод можно сделать исходя из несовпадения опытных данных с теоретическими представлениями об индуктивном эффекте заместителей? Исходя из многочисленных исследований было сделано предположение, что помимо индуктивного эффекта НЕКОТОРЫЕ, НО НЕ ВСЕ ЗАМЕСТИТЕЛИ обладают еще одним электронным эффектом, который называется мезомерным и обозначается М. Причем заместитель может быть акцепторным по индуктивному механизму, но донором по мезомерному, то есть эти два электронных эффекта являются независимыми. Наличие мезомерного эффекта у ряда заместителей, конечно, несколько усложняет ситуацию, поскольку заместители недостаточно классифицировать на донорные и акцепторные, к примеру атом фтора – акцкптор по индуктивному механизму, но донор по мезомерному.
О донорных в мезомерном отношении заместителях говорят, что они имеют +М‑эффект, а об акцепторных – что они обладают –М‑эффектом (все по аналогии с индуктивным эффектом).
Рассмотрим более подробно реакцию присоединения хлороводорода к фторэтилену. Основным продуктом этой реакции является соединение III (см. схему ниже).
Напомним, что реакция протекает через более стабильный карбокатион, а карбокатионы стабилизируются донорными заместителями, то есть обладающими +I и +М эффектами (в случае наличия мезомерного эффекта). Поскольку на опыте найдено, что основной продукт реакции – вещество III, то получается, что из двух изомерных катионов ‑ I или II – более стабильным является катион I, хотя он и дестабилизирован ‑I‑эффектом атома фтора. Что же тогда обеспечивает большую стабильность катиона I?

Нетрудно догадаться, что большая стабильность катиона I обусловлена донорным +М-эффектом атома фтора, который в данном случае противодействует акцепторному ‑I‑эффекту и, вероятно, превосходит его (в данном случае). Но в чем же может быть причина донорного +М‑эффекта очень электроотрицательного атома фтора?
|
|
|
На основании изучения многочисленных опытных данных ученые пришли к выводу, что +М эффектом обладают группы, обладающие хотя бы одной неподеленной электронной парой. А у атома фтора их целых три!!!
Рассмотрим более подробно строение катиона I. Электронодефицитный атом углерода в катионе I характеризуется формальным зарядом +1, то есть у этого атома имеется вакантная орбиталь (см. П.2-3), в то время как у атома фтора имеются неподеленные электронные пары. Но ведь если у одного атома имеется вакантная орбиталь, а у другого – неподеленная электронная пара, то между этими атомами возможно образование связи по донорно-акцепторному механизму. То есть строение катиона I можно ТАКЖЕ представить формулой I/ (объясните возникновение формального заряда +1 на атоме фтора и исчезновение этого заряда на атоме углерода). Дополнительная связь между атомами углерода и фтора относится к связям π‑типа, а поэтому является достаточно слабой и легко рвется, к тому же, структура I/ несколько дестабилизирована наличием формального заряда +1 на очень электроотрицательном атоме фтора. Эти факторы приводят к тому, что формула I/, равно как и формула I, каждая в отдельности не совсем адекватно описывают строение реальной частицы.

Считается, что в таких случаях строение заряженной частицы более правильно изображать не в виде формулы I или I/, а в виде набора этих формул, отделенных двусторонней стрелкой, называемой знаком резонанса. В таком случае говорят, что катион является резонансно стабилизированным (стабилизированным, поскольку происходит размывание, делокализация положительного заряда, в данном случае между атомами углерода и фтора).
|
|
|
Считается также, что реально существующий катион является чем-то промежуточным между формами I и I/. Ни одна из этих форм не существует, а реально существующий катион правильно изображать в виде набора так называемых крайних резонансных структур. Наличие таких крайних резонансных структур обеспечивает делокализацию заряда и стабилизацию частицы, в данном случае эту стабилизацию обычно называют резонансной стабилизацией. Таковы основные положения теории резонанса в применении к катиону I. В дополнение, следует указать, что ПРИ ПЕРЕХОДЕ ОТ ОДНОЙ КРАЙНЕЙ РЕЗОНАНСНОЙ СТРУКТУРЫ К ДРУГОЙ ВСЕ АТОМЫ ОСТАЮТСЯ НА СВОЕМ МЕСТЕ, ОНИ НЕ МЕНЯЮТ СВОЕГО ПОЛОЖЕНИЯ, МЕНЯЕТСЯ ЛИШЬ СПОСОБ ИХ СВЯЗАННОСТИ, А ИМЕННО РАЗРЫВАЕТСЯ ИЛИ ОБРАЗУЕТСЯ НОВАЯ π‑СВЯЗЬ. ТЕОРИЯ РЕЗОНАНСА ПЫТАЕТСЯ НАИБОЛЕЕ АДЕКВАТНО ОПИСАТЬ РАСПРЕДЕЛЕНИЕ СВЯЗЕЙ В РЕАЛЬНОЙ ЧАСТИЦЕ, ХАРАКТЕРИЗУЮЩЕЙСЯ КОНКРЕТНОЙ СТРУКТУРОЙ, ТО ЕСТЬ ПОЛОЖЕНИЕМ АТОМОВ В ПРОСТАНСТВЕ. ТЕОРИЯ РЕЗОНАНСА ОПИСЫВАЕТ СВЯЗАННОСТЬ ЭТИХ АТОМОВ ПУТЕМ НАПИСАНИЯ НЕСКОЛЬКИХ РЕЗОНАНСНЫХ ГИБРИДОВ И ПРИМЕНИМА В ТЕХ СЛУЧАЯХ, КОГДА ОДНА СТРУКТУРНАЯ ФОРМУЛА НЕДОСТАТОЧНО АДЕКВАТНО ОПИСЫВАЕТ СТРУКТУРУ ЧАСТИЦЫ, ЧТО ВСТРЕЧАЕТСЯ, К ПРИМЕРУ, ПРИ ВЫРАВНИВАНИИ, УСРЕДНЕНИИ СТЕПЕНИ ДВОЕСВЯЗАННОСТИ (как в молекуле бензола, сульфат‑анионе, нитрат‑анионе, фосфат‑анионе, ацетат‑анионе, аллильном катине, аллильном анионе, аллильном радикале).
Важно понимать, что иногда для удобства рисуется лишь одна из структур – I или I/ -при этом подразумевается, что читатель знаком с основами теории резонанса и понимает, что строение реальной частицы (в данном случае катиона) более адекватно описывать в виде набора структур.
Рассмотрим еще один пример – присоединение хлороводорода к дигидропирану (см. схему ниже). Основной продукт этой реакции изображен ниже. Опять-таки, атом кислорода за счет своей высокой электроотрицательности обладает ‑I‑эффектом, а за счет наличия неподеленных электронных пар противоположным по действию +М‑эффектом. Реакция протекает через резонансно стабилизированный катион, в котором часть положительного заряда делокализована и на атоме кислорода. Обратите внимание на формальные заряды атомов кислорода и углерода в крайних резонансных структурах, а также на то, что заряд каждой из резонансных структур равен +1, что отражает ЗАКОН СОХРАНЕНИЯ ЗАРЯДА.
|
|
|

В отличие от атомов фтора, хлора, кислорода и азота, которые НЕПОСРЕДСТВЕННО связаны с электронодефицитным карбокатионным центром, такой заместитель, как трифторметильная группа CF3 не обладает мезомерным эффектом. Несомненно, каждый атом фтора в этой группе обладает тремя неподеленными электронными парами, однако атомы фтора не связаны непосредственно с карбокатионным центром, что не дает им возможности проявить свой мезомерный эффект.

Действительно, для проявления +М эффекта орбиталь, на которой располагается неподеленная электронная пара, должна непосредственно перекрываться с пустой орбиталью карбокатионного центра. Именно в этом случае за счет неподеленной электронной пары и вакантной орбитали соседнего атома по донорно-акцкепторному механизму образуется дополнительная ковалентная связь, что обеспечивает дополнительную стабилизацию системы.
Напомним, что карбокатионный атом углерода, имеющий формальный заряд +1, находится в состоянии sp2 гибридизации. При этом связи С-Н, С-F и С-С в фторэтильном катионе (см. рисунок ниже) образованы за счет трех sp2-гибридных орбиталей атома углерода, а поэтому связи С-Н, С-F и С-С лежат в одной плоскости. Атом углерода обладает также вакантной p-орбиталью, располагающейся перпендикулярно плоскости, в которой лежат связи С-Н, С-F и С-С.

Атом фтора образует одну связь С‑F и обладает тремя неподеленными электронными парами. Атому фтора можно приписать sp3-гибридизацию, однако для удобства можно также полагать, что он находится в состоянии sp2-гибридизации (ведь гибридизация – это всего лишь модель). При этом одна из sp2-гибридных орбиталей идет на образование связи C‑F, а на двух других располагаются неподеленные электронные пары атома фтора. Три sp2-гибридные орбитали атома фтора лежат в одной плоскости, перпендикулярно которой находится p‑орбиталь, на которой находится третья неподеленная электронная пара атома фтора.
|
|
|
Таким образом, как карбокатионный атом углерода, так и атом фтора имеют p‑орбитали, которые перекрываются. Понятно, что по отношению к пустой p-орбитали атома углерода, p‑орбиталь атома фтора, занятая двумя электронами, является донорной. Ведь π‑связь С‑F образуется по донорно‑акцепторному механизму и именно атом фтора является донором. В этом и проявляется +М‑эффект фтора.
Отличие индуктивного эффекта, обусловленного высокой электроотрицательностью фтора, состоит в том, что индуктивный эффект действует по σ‑связи C-F, причем электронная пара этой связи сдвинута ближе к более электроотрицательному атому фтора.
Мезомерный же эффект распостраняется по перекрывающимся p‑орбиталям. В данном случае, поскольку на p‑орбитали фтора имеется два электрона, а на p‑орбитали углерода ни одного электрона, то атом фтора проявляет донорные свойства по отношению к углероду, хотя и является более электроотрицательным.
ЗАПОМНИТЬ!!!
В реакциях электрофильного присоединения к алкенам +М‑эффект заместителя (в случае его наличия) является очень сильным и обычно перекрывает –I‑эффект того же заместителя.
Итак, мы рассмотрели ряд заместителей, обладающих +М‑эффектом, то есть неподеленной электронной парой, за счет которой эти заместители способны стабилизировать карбокатионный центр, обладающий пустой р‑орбиталью.
Нетрудно догадаться, что заместители, обладающие ‑М‑эффектом должны обладать пустой орбиталью, за счет которой они могут стабилизировать карбанионный центр, обладающий неподеленной электронной парой (к примеру, атом С‑ в метильном анионе СН3‑).
Заместителей, с пустой орбиталью на атоме не так много. К примеру такой заместитель, как B(CH3)2 обладает пустой орбиталью, принадлежащей атому бора, а значит он обладает ‑М‑эффектом. Очевидно, что такой заместитель способен стабилизировать карбанионы, поскольку он способен приобретать некоторый δ‑ и таким образом участвовать в делокализации отрицательного заряда в карбанионе.
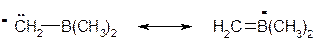
Группа СН2В(СН3)2 не обладает мезомерным эффектом по той же причине, по которой мезомерным эффектом не обладает группа СF3: у углерода нет ни пустой орбитали, ни неподеленной электронной пары.
Групп, подобных B(CH3)2, с пустой орбиталью на атоме очень мало. Тем не менее, имеется целый ряд групп, обладающих –М‑эффектом, хотя ВРОДЕ БЫ и не обладающих пустой орбиталью.
Чтобы уяснить себе этот вопрос, рассмотрим строение аллильного катиона. Каждый из атомов углерода в нем находится в sp2‑гибридном состоянии, за счет трех гибридных орбиталей образует три σ‑связи, лежащих в одной плоскости. Каждый из атомов углерода имеет также по р‑орбитали, располагающейся перпендикулярно плоскости, где находятся σ‑связи. Данные физических исследований, показывают, что расстояние между первым и вторым атомом углерода в аллильном катионе в точности равно расстоянию между вторым и третьим углеродными атомами. Таким образом, изображать аллильный катион в виде формулы I (см. ниже) не совсем верно, поскольку согласно этой формуле расстояние между двумя углерода, связанными двойной связью, должно быть меньше, чем расстояние между углеродными атомами, связанными лишь одинарной связью.
|
|
|

В рамках теории резонанса считается, что строение аллильного катиона более правильно изображать набором двух резонансных гибридов I и II – см. ниже. Поскольку обе формулы I и II идентичны, то вклад каждой из этих структур в строение реального аллильного катиона составляет 50%.

Переход от структуры I к структуре II можно пояснить несколькими способами.
К примеру, электронодефицитный атом углерода в структуре I обладает пустой орбиталью, то есть является электрофильным центром. Как и любой электрофил (только в данном случае он находится внутри самой частицы), он может присоединяться к двойной углерод‑углеродной связи, при этом π‑связь разрывается гетеролитически, и за счет двух электронов π‑связи и пустой орбитали электрофила С+ образуется новая углерод‑углеродная связь. Перемещение электронной пары π‑связи можно изобразить следующим образом:

Такая форма записи в целом адекватно описывает строение аллильного катиона и является альтернативой набору из двух крайних резонансных гибридов I II, отделенных двусторонней стрелкой.
Поясним переход от структуры I к структуре II еще одним способом. Подвергнем π‑связь в структуре I гетеролитическому разрыву указанным на рисунке (см. ниже) образом. При этом получится структура I/. В этой структуре центральный атом, обладающий неподеленной электронной парой, может образовать π‑связь с любым из крайних атомов углерода, давая при этом структуры I и II. В принципе, структуру I/ также можно считать одним из крайних резонансных гибридов аллильного катиона, однако поскольку в этой структуре разорвана π‑связь, а в структурах I и II эта связь не разорвана, то структура I/ относительно нестабильна и не вносит существенного вклада в реальное строение аллильного катиона.

Таким образом, реальное строение аллильного катиона более правильно отражать набором из двух резонансных структур:

Переход от первой структуры ко второй по сути дела отражвет +М‑эффект винильной группы (‑СН=СН2). По сути дела эта группа (то есть двойная связь С=С) тоже является донором электронной пары, только не неподеленной электронной пары, как в случае +М‑эффекта атома фтора, а пары электронов, образующих π‑связь. По сути дела, π‑связь является относительно слабой, легко рвется, а поэтому может участвовать в резонансной стабилизации частицы. Перемещение электронной пары π‑связи к карбокатионному центру изображается следующим образом: стрелка начинается ровно посередине связи С=С (там эта пара находилась) и заканчивается ровно посередине между атомами углерода, образующими новую π‑связь:

Интересно, что винильная группа (‑СН=СН2) способна проявлять не только +М, но и –М‑эффект!!! К примеру, строение аллильного аниона можно представить набором следующих крайних резонансных структур:

Переход от одной структуры ко второй можно объяснить примерно аналогично тому, как был объяснен переход от одной резонансной структуры аллильного катиона к другой. Так, гетеролитический разрыв π‑связи и образование новой π‑связи по донорно‑акцепторному механизму приводит к переходу от одной крайней резонансной структуры ко второй:

Итак, винильная группа способна проявлять как +М, так и –М‑эффекты. То же самое можно сказать о фенильной группе. Например, ниже изображена резонансная стабилизация бензильного катиона и аниона. При этом положительный или отрицательный заряд (+ или ‑) всегда находится рядом со связью С=С, то есть в указанных формулах всегда можно мысленно выделить структуру аллильного катиона (или аниона), что помогает правильно нарисовать все возможные резонансные структуры. На изображенных ниже резонансных структурах аллильный фрагмент, позволяющий легко перейти к следующей структуре, выделен жирным шрифтом. Важно рисовать структуры последовательно, не перескакивая, чтобы отразить все возможные резонансные гибриды. При этом положительный или отрицательный заряд (+ или ‑) как бы пробегает по бензольному кольцу:

По сути дела, из всего вышесказанного можно сделать вывод, что мезомерный эффект винильной (и фенильной) группы связан с легкостью разрыва π‑связи, а при гетеролитическом разрыве π‑связи получается структура, в которй у одного из атомов углерода имеется пустая орбиталь (он может проявлять‑М‑эффект), а у соседнего углеродного атома имеется неподеленная электронная пара (он, соответственно, может проявлять +М‑эффект). Считается, что структура с разорванной π‑связью даже вносит некоторый, хотя и небольшой, вклад в реальную структуру алкена или другого ненасыщенного соединения:

Аналогичные биполярные резонансные структуры вносят некоторый (причем больший, чем в случае алкенов) вклад в строение карбонильных соединений, содержащих связь С=О. При этом, естественно, на атоме кислорода может возникать лишь отрицательный заряд, а структура с положительным зарядом на атоме кислорода, ввиду ее нестабильности, не вносит существенного вклада. Например, резонансную стабилизацию формальдегида можно отобразить следующим образом:

Заметим, что в структуре II на атоме углерода имеется формальный положительный заряд, то есть имеется вакантная р‑орбиталь. А ЭТО ОЗНАЧАЕТ, ЧТО ФОРМИЛЬНАЯ ГРУППА –СНО МОЖЕТ ПРОЯВЛЯТЬ –М‑ЭФФЕКТ и стабилизировать карбанионы. К примеру, ниже изображена резонансная стабилизация карбаниона, полученного отрывом протона от ацетальдегида. Резонансная стабилизация этой частицы во многом схожа со стабилизацией аллильного аниона, за тем лишь исключением, что один из атомов углерода заменен атомом кислорода.
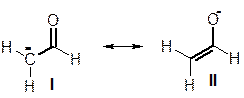
Итак, формильная группа СНО обладает –М и –I‑эффектами (‑I, поскольку в нее входит электроотрицательный атом кислорода, ситуации аналогична той, которая имеет место в группе CF3, также обладающей –I‑эффектом).
Точно таким же ‑М‑эффектом обладает ацетильная группа СОСН3, нитро‑группа NO2, нитрозо‑группа NO, циано‑группа CN и другие, то есть такие группы, где центральный атом связан кратной связью с более электроотрицательным атомом (обычно кислородом). К примеру:

Понятно также, что такие группы как СН2NO2, CH2CN, CH2CHO не обладают мезомерным эффектом, поскольку они образуют связь через атом углерода, который при этом четырехвалентен, а значит, не обладает ни вакантными орбиталями, ни неподеленными электронными парами.
|
|
|


