 |
Определение содержания нитротолуола
|
|
|
|
Анализ основан на восстановлении нитропроизводного до амина и последующем его диазотировании.
Навеску смеси (ок. 1 г) взвешивают с точностью до 0,01 г в конической колбе вместимостью 250 мл. Навеску растворяют в смеси 40 мл 80% уксусной кислоты и 20 мл концентрированной соляной кислоты.
Добавив 5 г цинковой пыли, колбу соединяют с обратным водяным холодильником и смесь нагревают 15 мин. Затем кипятят еще 15 мин. Раствор охлаждают и фильтруют на воронке Бюхнера. Фильтрат и промывные воды сливают в мерную колбу вместимостью 250 мл, доводят до метки дистиллированной водой и перемешивают.
Отбирают 80 мл раствора и титруют 0,1 н раствором NaNO2. Конец диазотирования определяют по йодкрахмальной бумаге. Капля титруемой смеси наносится на бумагу стеклянной палочкой через 3 минуты после прибавления последней порции NaNO2 и хорошего перемешивания.
Первое титрование дает приблизительный результат. Второе выполняется гораздо быстрее и точнее.
Параллельно ставят контрольный опыт для определения чувствительности йодкрахмальной бумаги. Для этого в стакан наливают все реактивы в таком же количестве, как указано в методике, за исключением анализируемого продукта, и титруют (по каплям) тем же раствором до появления характерного посинения йодкрахмальной бумаги.
Массовую долю нитротолуола (%) в смеси вычисляют по уравнению

 (1)
(1)
где V1 - объем 0,1н раствора NaNO2 на титрование, мл;
V2 - объем раствора, израсходованный в контрольном опыте;
0,0137 - количество нитротолуола, соответствующее 1 мл точно 0,1 н раствора NaNO2, г;
m - масса навески смеси, г.
Результаты работы оформляют в виде табл. 1,2,3.
Таблица 1
Нитрующая смесь
| Чистые компоненты | Масса, Г | Масс. доля, % |
| HNO3 H2SO4 H2O | ||
| Всего |
|
|
|
Таблица 2
Исходная смесь
| Реактив | Масса, г | Плотность, г/см3 | Объем, мл |
| Толуол HNO3 H2SO4 | |||
| Всего |
Таблица 3
Анализ смеси
| Параметры | Определения | ||
| Масса колбы, г Масса навески, г Расход 0,1н р-ра NaNO2 Массовая доля мононитропроизводного, % |
Обычный состав получаемой смеси изомеров, %: орто - 58; пара - 38; мета - 4. Все изомеры ядовиты (окисляют гемоглобин). В промышленности их разделяют совмещением методов ректификации под вакуумом и вымораживания.
На основе результатов работы определяют мольный выход мононитропроизводного по исходному сырью.
Сопоставлением результатов работ, выполненных при различных условиях можно оценить влияние основных факторов:
- температуры нитрования;
- Ф.Н.А.;
- времени процесса.
По данной методике возможно провести нитрование других алкилзамещенных бензола, учитывая их реакционную способность. Например, о-ксилол нитруется легче, поэтому можно использовать более мягкие условия. Методика анализа не меняется
.
Тема 5. АЦИЛИРОВАНИЕ
Реакция ацилирования - это замещение атома водорода ацильным остатком кислородсодержащей минеральной кислоты, карбоновой кислоты или сульфокислоты. Ацильную группу можно ввести в аминогруппу (N-ацилирование), гидроксильную (О-алкилирование) или в ароматическое кольцо (С-ацилирование).

Характерной чертой реакций ацилирования свободной кислотой является их обратимость из-за гидролиза продукта реакционной водой. Кислоты ацилируют амины и этерифицируют спирты, но с фенольным гидроксилом они не реагируют. Поэтому в качестве ацилирующих средств чаще используют производные кислот: сложные эфиры, ангидриды или хлорангидриды. Кроме того, эффективно ацилирует т.н. кетен С2Н2О, простейший представитель класса кетенов, т.е. соединений имеющих группу С=С=О.
|
|
|
N-Ацилирование
Реакция ацилироввания аминов является реакцией электрофильного замещения атома водорода в аминогруппе.
N-Ацилирование аминов применяют для временной защиты аминогруппы в соединениях, подвергаемых сульфированию, нитрованию, галогенированию и для получения соединений, обладающих определенными практически важными свойствами. Для защиты аминогруппы чаще всего используют муравьиную или уксусную кислоты, во втором случае - разнообразные карбоновые кислоты и их производные, обычно ангидриды и хлорангидриды.
Механизм реакции N-ацилирование аминов может быть представлен следующей схемой:

Лимитирующей стадией является образование промежуточного продукта, который получается путем внедрения неподеленной пары электронов атома азота в электронный пробел углерода карбоксильной группы. Электронодонарные заместители в ароматическом кольце амина увеличивают, электроноакцепторные уменьшают скорость реакции ацилирования. Противоположное влияние на скорость реакции оказывают заместители в остатке карбоновой кислоты. Здесь электроноакцепторные заместители увеличивают, а электронодонарные - уменьшают скорость реакции ацилирования. Ряд ацилирующих агентов по их сравнительной реакционной способности имеет вид:

Анион карбоновой кислоты практически уже не способен ацилировать ароматические амины.
Для временной защиты аминогруппы часто используют реакцию N-формилирования. Обычно ее проводят, нагревая амин с избытком муравьиной кислоты;

Реакция обратима, но образующаяся вода отгоняется с избытком муравьиной кислоты, и благодаря этому процесс доходит до конца. В некоторых случаях, когда формилирование амина надо провести в мягких условиях, пользуются смешанным муравьино-уксусным ангидридом, который получают непосредственно перед реакцией, добавляя уксусный ангидрид к избытку муравьиной кислоты

В смешанном ангидриде формильный остаток значительно более активен, чем ацетильный и, поэтому реакция с амином идет однозначно в сторону образования N-формильного производного:

При проведении этой рекции можно использовать обычную 85% муравьиную кислоту, связывая воду необходимым количеством уксусного ангидрида.
|
|
|
Для временной защиты аминогруппы особое значение имеет реакция N-ацетилирования:

Реакция обратима, поэтому обычно предпочитают использовать 98-100%-ную уксусную кислоту, которую берут с небольшим избытком (10-15%) против теоретического количества. После нескольких часов нагревания при кипении избыток кислоты вместе с образовавшейся водой отгоняют от продукта реакции.
Реакция аминов с ангидридом кислот протекает очень быстро и с выходами близкими к количественным. Ее можно осуществить нагреванием амина с уксусным ангидридом в течение нескольких минут. Продукт реакции выливают в воду и отсасывают кристаллическое ацетильное производное. Эту реакцию можно проводить в среде бензола. Амин растворяют в сухом бензоле и постепенно приливают ангидрид. Реакция экзотермична и растворитель закипает. Если ацильное производное плохо растворимо в бензоле, оно по охлаждении выпадает в осадок.
Этот метод применяют также для ацилирования кислотами, имеющими большую молекулярную массу, ароматических аминов. Например, действием бензольного раствора ангидрида бензойной кислоты на амины получают их бензойные производные.
Кроме использования для временной защиты аминогрупп, реакции ацилирования широко применяются в синтезе промежуточных продуктов и лекарственных препаратов, в молекулах которых сохраняются введенные ацильные группы. Простейший ацилирующий агент этого назначения - фосген (карбонилхлорид). Его вводят в реакцию с разнообразными ароматическими аминами, содержащими свободные аминогруппы

Реакцию большей частью ведут в водном растворе, пропуская через него газообразный фосген. Для нейтрализации образующегося HCl используют Na2CO3 или NaOH.
Лекарственный препарат фенацетин получают ацетилированием п-фенетидина

О-Ацилирование
Этерификация фенольного гидроксила в готовых лекарственных препаратах смягчает его едкие и раздражающие свойства, например в фениловом эфире салициловой кислоты (салоле).
|
|
|
Ацилирование оксигруппы в ароматических соединениях проводится реже, чем ацилирование аминогруппы. Реакция с оксисоединениями идет не так энергично. Для связывания воды применяют РСl3 или РОСl3. Примером ацилирования фенола может служить получение салола

Часто для ацилирования оксисоединений используют ангидриды или хлорангидриды кислот. Так, ацилированием салициловой кислоты уксусным ангидридом получают аспирин (ацетилсалициловую кислоту)
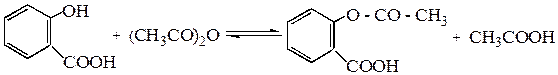
При ацилировании хлорангидридами кислот для связывания выделяющегося хлористого водорода к реакционной массе добавляют щелочь, соду или поташ.
Лабораторная работа
«ПОЛУЧЕНИЕ ПАРА-АЦЕТОАМИНОФЕНОЛА»

|
|
|


