 |
15. Влияние различных факторов на кислотные и основные свойства веществ. Примеры.
|
|
|
|
15. ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА ВЕЩЕСТВ. ПРИМЕРЫ.
Рассмотрим несколько примеров, как структура (природа радикала у кислотного центра) влияет на кислотность органических соединений. Известно, что в ряду ОН-кислот кислотные свойства убывают в следующем порядке: карбоновые кислоты > фенолы > спирты. В этом ряду радикалами у кислотных центров соответственно являются ацил с ярко выраженным акцепторным характером, арил, относящийся к акцепторным заместителям, но уступающий ацилам, и алкил, характеризующийся хотя и слабым, но электронодонорным эффектом. Указанные радикалы до разрыва связи О-Н будут различным образом влиять на ее поляризацию: чем выше акцепторность радикала, тем выше полярность связи (статический фактор). Однако более существенное влияние заместителей будет проявляться после разрыва О-Н-связи: чем выше степень делокализации заряда аниона, тем выше его устойчивость (динамический фактор). А чем стабильнее частица (в нашем случае кислородцентрированный анион), тем ниже энергетические барьеры на пути ее образования. В рассматриваемых примерах устойчивость анионов будет уменьшаться в следующем порядке: ацилат-анион > феноксид-анион > алкоксид-анион:
В первом случае делокализация заряда достигается за счет его распределения между двумя эквивалентными атомами кислорода. В феноксид-анионе делокализация заряда достигается за счет сопряжения электронных пар атома кислорода с p-системой ароматического ядра, в результате чего часть электронной плотности с атома кислорода переносится на ароматическое ядро (отрицательный заряд на атоме кислорода снижается). Высокая степень локализации заряда на атоме кислорода в алкоксид-анионе делает его наименее стабильным и соответственно наиболее трудно образующимся.
|
|
|
Легко понять, что введение в радикал у кислотного центра электроноакцепторных заместителей будет способствовать повышению кислотности всех типов кислот. Особенно резкое повышение кислотности СН-кислот наступает в случае, если введение такого заместителя придает соединению возможность существовать в нескольких таутомерных формах. Сравните кислотность двух СН-кислот: хлороформа и нитрометана (см. табл. 1). Из таблицы видно, что кислотность последнего почти на пять порядков выше. Столь значительная разница в кислотности двух указанных соединений обусловлена тем, что нитрометан может существовать в двух таутомерных формах с общим мезомерным анионом.
Аналогичный подход можно использовать для объяснения подвижности a-водородных атомов в карбонильных соединениях.
Кратко остановимся на влиянии электронных факторов на основность органических соединений. В качестве оснований могут выступать анионы или нейтральные молекулы, содержащие атомы с неподеленными электронными парами. В роли последних чаще всего выступают азот- и кислородсодержащие соединения. Сила оснований будет определяться концентрацией электронной плотности на основных центрах (центрах протонирования). Влияние электронных факторов на основность органических соединений будет прямо противоположным тому, что выше было рассмотрено для кислот: электронодонорные заместители у основных центров будут усиливать основность, акцепторные - ее понижать.
Кроме оснований, понимаемых в рамках широкой трактовки этого термина, существует более узкая трактовка - органические основания. Это органические соединения, используемые на практике в качестве акцепторов протонов. К ним относятся нейтральные основания (третичные амины, амидины) и анионные основания (алкоголяты и амиды щелочных металлов, металлоорганические соединения). В препаративных синтезах эту роль чаще всего выполняют третичные амины - триэтиламин, диметиланилин, пиридин. Используя рассмотренные выше подходы в оценке кислотно-основных свойств органических соединений, можно на качественном уровне дать характеристику любому органическому соединению.
|
|
|
16. СПИРТЫ И ФЕНОЛЫ. МНОГОАТОМНЫЕ СПИРТЫ.
17. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ И ФЕНОЛОВ.
Одноатомные спирты, фенолы и их производные
Производные алифатических углеводородов, в которых один или несколько атомов водорода замещены гидроксильной группой, называют спиртами; аналогичные производные ароматических углеводородов называют фенолами.
В зависимости от числа гидроксильных групп спирты и фенолы бывают одно-, двух-, трехатомными и т. д. Спирты, содержащие две гидроксильные группы или более, называют многоатомными. В зависимости от того, у какого атома углерода находится функциональная группа, спирты называют первичными, вторичными или третичными.
Простые эфиры можно рассматривать как производные спиртов или фенолов, в которых атом водорода гидроксильной группы замещен алкильным или арильным радикалом. Простые эфиры бывают также ненасыщенными (например, виниловые) и циклическими. Виниловые эфиры CH2=CH-OR являются производными винилового спирта. Виниловый спирт CH2=CH-OH - простейший представитель соединений, называемых енолами, поскольку в их составе у атома углерода двойной связи (-ен) находится гидроксильная группа (-ол). Енолы - крайне неустойчивые соединения, например виниловый спирт в момент его образования изомеризуется в уксусный альдегид.
Простейший из циклических эфиров - этиленоксид - образуется при каталитическом окислении этилена. 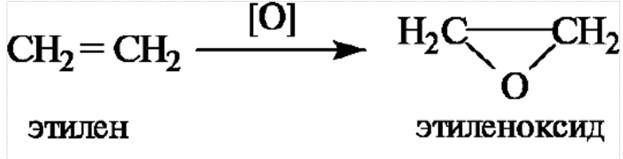
Диэтиловый эфир применяют для ингаляционного наркоза, а также как растворитель веществ животного и растительного происхожедения. При хранении на воздухе диэтиловый эфир легко образует взрывчатый гидропероксид. Бутилвиниловый эфир используют для получения полимера, применяемого в качестве ранозаживляющего средства, под названием винилин («бальзам Шостаковского»).
|
|
|
Для спиртов характерна структурная изомерия (изомерия углеродного скелета, изомерия положения заместителя или гидроксильной группы), а также межклассовая изомерия.
Горение:
C2H5OH + 3O2  2CO2 +3H2O + Q
2CO2 +3H2O + Q
Реакции с щелочными и щелочноземельными металлами (" кислотные" свойства):
Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов (" замещаться" на них).
- 2Na + 2H—O—H
 2NaOH + H2
2NaOH + H2 
2Na + 2R—O—H 2RONa + H2
2RONa + H2 
- Реакции с галогеноводородами:
C2H5OH + HBr 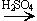 C2H5Br + H2O
C2H5Br + H2O
- Внутримолекулярная дегидратация (t > 140oС, образуются алкены):
C2H5OH 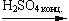 C2H4 + H2O
C2H4 + H2O
- Межмолекулярная дегидратация (t < 140oС, образуются простые эфиры):
2C2H5OH 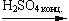 C2H5OC2H5 + H2O
C2H5OC2H5 + H2O
- Окисление (мягкое, до альдегидов):
CH3CH2OH + CuO 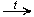 CH3—CHO + Cu + H2O
CH3—CHO + Cu + H2O
|
|
|


