 |
21. Высшие жирные карбоновые кислоты: классификация, номенклатура, структура, физические свойства.
|
|
|
|
21. ВЫСШИЕ ЖИРНЫЕ КАРБОНОВЫЕ КИСЛОТЫ: КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА, СТРУКТУРА, ФИЗИЧЕСКИЕ СВОЙСТВА.
ВЖК — алифатические одноосновные карбоновые кислоты с открытой цепью, содержащиеся в этерифицированной форме в жирах, маслах и восках растительного и животного происхождения. Жирные кислоты, как правило, содержат неразветвленную цепь из четного числа атомов углерода (С4-24, включая карбоксильный углерод) и могут быть как насыщенными, так и ненасыщенными.
Классификация:
1. Насыщенные: Жирная кислота считается насыщенной, если все свободные углеродные цепи связаны атомом водорода. Насыщенные жиры содержатся, в основном, в животных жирах и тропических маслах, и организм также производит их из углеводов.
стеариновая (C17H35COOH)
пальмитиновая (C15H31COOH)
3. Ненасыщенные: полиненасыщенные жирные кислоты имеют две или более двойных связей, поэтому им не хватает уже четырех атомов водорода и выше. Все жиры и масла, как растительного так и животного происхождения, представлены комбинацией насыщенных жирных кислот, мононенасыщенных жирных кислот и полиненасыщенных линолевой и линоленовой кислот.
пальмитолеиновая (C15H29COOH, 1 двойная связь)
олеиновая (C17H33COOH, 1 двойная связь)
линолевая (C17H31COOH, 2 двойные связи)
линоленовая (C17H29COOH, 3 двойные связи)
арахидоновая (C19H31COOH, 4 двойные связи,
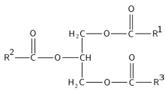
К незаменимым жирным кислотам относятся всего две жирных кислоты: линолевая и линоленовая, и из линолевой синтезируется арахидоновая – они образуют витамин F. Остальные относятся к заменимым: пальмитолеиновая (C15H29COOH, 1 двойная связь), олеиновая (C17H33COOH, 1 двойная связь), стеариновая (C17H35COOH), пальмитиновая (C15H31COOH).
Для названия Ненасыщенных жирных кислот наиболее удобна ω -номенклатура, в соответствии с которой структура любой ненасыщенной жирной кислоты может быть выражена тремя цифрами: длиной цепи (количеством углеродных атомов), количеством двойных связей и количеством углеродных атомов между двойной связью и метильной группой (ω -углеродом). Наличие двойной связи может быть также обозначено цифрой, указывающей начало двойной связи, считая с карбоксильного конца молекулы:
|
|
|
Олеиновая кислота (18: 1 ω 9), или Цис - 9 - октадеценовая кислота.
Линолевая кислота (18: 2 ω 6), или Цис-9-Цис-12-октадекадиеновая кислота.
Линоленовая кислота (18: 3 ω 3), или Цис-9, Цис-12, Цис-15-октадекатриеновая кислота.
Арахидоновая кислота (20: 4 ω 6), или (эйкозатетраен-5, 8, 11, 14-овая кислота), Цис-5, Цис-8, Цис-11, Цис-14- эйкозатетраеновая кислота.
Химические свойства:

Химические свойства ВЖК: образование солей, реакция этерификации с образованием тиоэфиров (ацилКоА).
Образование солей:
С17Н35СООН + NaOH → С17Н35СООNа + Н2О
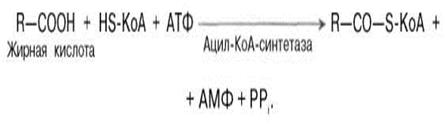
Реакция этерификации ВЖК сопровождается активацией ВЖК и получением АцилКоА. Реакция происходит на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Катализируется ферментом ацил-КоА-синтетазой:
22. ДИКАРБОНОВЫЕ КИСЛОТЫ: ЩАВЕЛЕВАЯ, МАЛОНОВАЯ, ЯНТАРНАЯ, ГЛУТАРОВАЯ, ФУМАРОВАЯ. ИХ РОЛЬ В ОРГАНИЗМЕ. Соли щавелевой кислоты - оксалаты.
Щавелевая кислота НООС—СООН — простейшая двухосновная кислота. Ее соли называют оксалатами.
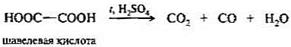 Na2C2O4 --tà Na2CO3+CO,
Na2C2O4 --tà Na2CO3+CO,
Малоновая кислота НООС-СН2-СООН
 ,
, 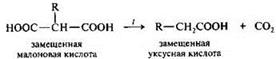
Янтарная кислота НООС(СН2)2СООН
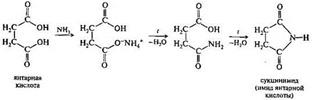
Глутаровая кислота НООС(СН2)2СООН

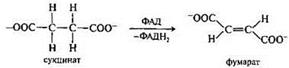
Ненасыщенные дикарбоновые кислоты: фумаровая, малеиновая их пространственное строение. Превращение янтарной кислоты в фумаровую кислоту как пример биологической реакции дегидрирования.
Малеиновая кислота
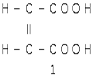 ,
,
Фумаровая кислота

Превращение янтарной кислоты в фумаровую кислоту:
|
|
|
Насыщенные дикарбоновые кислоты – это карбоновые кислоты, содержащие 2 карбоксильные группы –СООН, с общей формулой НООС-R-СООН, где R-любой двухвалентный органический радикал. Ненасыщенные карбоновые кислоты содержат в углеводо-родной цепи одну или несколько двойных или тройных связей.
Система дикарбоновых аминокислот, к которой относят также соответствующие α -кетокислоты, теснейшим образом связана не только с азотистым метаболизмом в целом, но и с обменом липидов и углеводов. Ранее отмечалась особая роль дикарбоновых аминокислот и ферментов, катализирующих их превращения, в перераспределении азота в организме, дезаминировании и синтезе природных аминокислот (реакции трансде-заминирования и трансреаминирования), в образовании конечных продуктов белкового обмена – синтезе мочевины. Аспарагиновая кислота принимает непосредственное участие в орни-тиновом цикле мочевинообразования, в реакциях трансаминирования и биосинтезе углеводов (гликогенная аминокислота), карнозина и ансерина, пуриновых и пиримидиновых нуклеотидов (см. главу 14), а также в синтезе N-ацетиласпарагиновой кислоты в ткани мозга. Роль последней, содержащейся в довольно высоких концентрациях в ткани мозга млекопитающих, пока не выяснена. Глутаминовая кислота, являющаяся гликогенной и заменимой аминокислотой для человека и животных, также включается в синтез ряда специфических метаболитов, в частности глутатиона и глутамина. Помимо участия в транспорте аммиака и регуляции кислотно-щелочного равновесия, глутамин – это незаменимый источник азота в ряде синтезов, в частности в биосинтезе пуриновых и пиримидиновых нуклеотидов, амино-сахаров, в обезвреживании фенилуксусной кислоты (синтез фенилацетил-глутамина) у человека и человекообразных обезьян, а также в синтезе витамина фолиевой кислоты (птероилглутаминовая кислота). Глутамин и аспарагин оказались, кроме того, эссенциальными факторами для роста некоторых нормальных и опухолевых клеток в культуре ткани; они не могут быть заменены ни друг другом, ни соответствующими дикарбоновыми аминокислотами. Это свидетельствует о том, что в условиях выращивания клеток в культуре ткани некоторые клетки теряют способность синтезировать эти амиды синтетазным или трансаминазным путем.
|
|
|
|
|
|


