 |
Получение спиртов. Фенолы. Химические свойства. 18. Альдегиды. Особенности строения карбонильной группы. Химические свойства альдегидов: образование полуацеталей и ацеталей, реакция диспропорционирования и альдольной конденсации, овр, образование основани
|
|
|
|
Получение спиртов
- Щелочной гидролиз галогеналканов (лабораторный способ): C2H5Cl + NaOH
 C2H5OH + NaCl.
C2H5OH + NaCl. - Гидратация алкенов: C2H4 + H2O
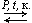 C2H5OH.
C2H5OH. - Брожение глюкозы: C6H12O6
 2C2H5OH + 2CO2
2C2H5OH + 2CO2  .
. - Синтез метанола: CO + 2H2
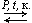 CH3OH
CH3OH
Многоатомные спирты
Примерами многоатомных спиртов является двухатомный спирт этандиол (этиленгликоль) HO—CH2—CH2—OH и трехатомный спирт пропантриол-1, 2, 3 (глицерин) HO—CH2—CH(OH)—CH2—OH.
Фенолы
Важнейшим представителем фенолов является фенол (гидроксобензол, старые названия - гидроксибензол, оксибензол) C6H5—OH.
Физические свойства фенола: твердое бесцветное вещество с резким запахом; ядовит; при комнатной температуре заметно растворим в воде, водный раствор фенола называют карболовой кислотой.
Химические свойства
- Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
2C6H5OH + 2Na 
| 2C6H5ONa | + H2 |
| фенолят натрия |
- C6H5OH + NaOH
 C6H5ONa + H2O
C6H5ONa + H2O
Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических.
- Замещение в бензольном кольце. Наличие гидроксильной группы в качестве заместителя в молекуле бензола приводит к перераспределению электронной плотности в сопряженной
 -системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто- и пара-положения) и уменьшается у 3-го и 5-го атомов углерода (мета-положение).
-системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто- и пара-положения) и уменьшается у 3-го и 5-го атомов углерода (мета-положение).
а) Реакция с бромной водой (качественная реакция):
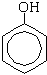
| + 3Br2 
| 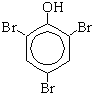
| + 3HBr |
Образуется 2, 4, 6-трибромфенол - осадок белого цвета.
б) Нитрование (при комнатной температуре):
- C6H5—OH + HNO3(разб. )
 H2O + O2N—C6H4—OH (смесь орто- и пара-изомеров)
H2O + O2N—C6H4—OH (смесь орто- и пара-изомеров)

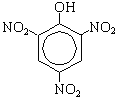
| + 3HNO3(конц. )  3H2O + 3H2O +
| 
|
По вторй реакции образуется 2, 4, 6-тринитрофенол (пикриновая кислота).
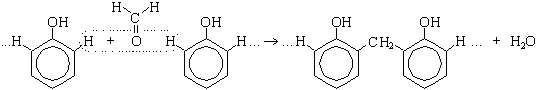
- Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы:
|
|
|
- Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета.
18. АЛЬДЕГИДЫ. ОСОБЕННОСТИ СТРОЕНИЯ КАРБОНИЛЬНОЙ ГРУППЫ. ХИМИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ: ОБРАЗОВАНИЕ ПОЛУАЦЕТАЛЕЙ И АЦЕТАЛЕЙ, РЕАКЦИЯ ДИСПРОПОРЦИОНИРОВАНИЯ И АЛЬДОЛЬНОЙ КОНДЕНСАЦИИ, ОВР, ОБРАЗОВАНИЕ ОСНОВАНИЙ ШИФФА.
Альдегиды – органические соединения, содержащие альдегидную группу СНО.
В зависимости от насыщенности углеводородного заместителя:
предельные (насыщенные) альдегиды (ацетальдегид);
непредельные (ненасыщенные) альдегиды (акролеин);
ароматические альдегиды (бензальдегид).
По числу карбонильных групп:
альдегиды с одной карбонильной группой (формальдегид);
диальдегиды (глиоксаль);
многоатомные альдегиды.
Альдегиды в кислой среде образуют полуацетали при взаимодействии со спиртами. Полуацеталь сохраняет свойства альдегида и качественные реакции, характерные для альдегидной группы( «серебряного зеркала» и др. ). При действии избытка спирта полуацеталь превращается в ацеталь, который не сохраняет свойства альдегидной группы. Гидролиз полуацеталя и ацеталя возможен только в кислой среде и не возможен в щелочной.
Реакция Канниццаро (диспропорционирования)
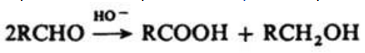
АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯ, взаимод. двух молекул альдегида или кетона (одинаковых или разных) в присутствии кислот или оснований с образованием  гидроксиальдегидов (альдолей), например:
гидроксиальдегидов (альдолей), например:
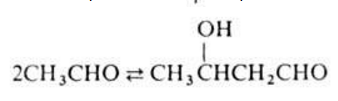
Альдольная конденсация двух различных альдегидов или кетонов наз. перекрестной. При этом возможно образование смеси различных альдолей:
|
|
|
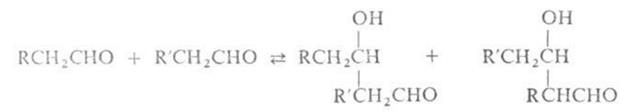
Шиффа основания образуются; 1) при взаимодействии ароматических альдегидов с анилинами: C6H5-NH2+O=HC—C6H5→ C6H5—N=CH—С6Н5+Н2O;
эта реакция обратима и в кислом растворе основания Шиффа гидролитически расщепляются; 2) в процессе синтеза вторичных аминов нитрил восстанавливается до альдимина, который затем частично гидролизуется до альдегида, а частично восстанавливается до первичного амина; образовавшиеся вещества взаимодействуют между собой с образованием оснований Шиффа; 3) непосредственным взаимодействием альдимина с первичным амином; 4) при нагревании вторичных аминов с гексаметилентетрамином в присутствии уксусной кислоты; 5) при синтезе альдегидов из анилида, сопровождающемся образованием оснований Шиффа (его соли) в качестве промежуточного продукта; 6) как промежуточный продукт при синтезе аминокислот из альдегидов; при этом альдегид, взаимодействуя с аммиаком, образует альдегидаммиак, который, отщепляя воду, превращается в соответствующее основание Шиффа.
Аминокислоты образуют основания Шиффа с альдегидами и другими соединениями, содержащими карбонильную группу. Определенную роль оснований Шиффа приписывают в ферментативном катализе. Дипептидазы и аминополипептидазы действуют на субстрат только в том случае, если он имеет свободную аминогруппу, с которой эти ферменты связываются, вероятно, посредством своих карбонильных групп, образуя основания Шиффа. Аналогичным образом осуществляется взаимодействие коферментов переаминирования с субстратами: фосфопиридоксаля с аминокислотами (через аминогруппу) и фосфопиридоксамина с кетокислотами (через кетогруппу).
|
|
|


