 |
29. Классификация и химические свойства моносахаридов, (см выше) овр моносахаридов.
|
|
|
|
29. КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА МОНОСАХАРИДОВ, (СМ ВЫШЕ) ОВР МОНОСАХАРИДОВ.
Химические свойства глюкозы
Получение: (C6H10O5)n + nH2O t, H+→ nC6H12O6
1. Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:
C6H12O6 → 2СH3-CH-COOH
│
OH молочная кислота
3. Маслянокислое брожение:
C6H12O6 → C3H7COOH + 2H2 ↑ + 2CO2↑
II. Свойства альдегидов
1. Реакция серебряного зеркала: Качественная реакция
СH2OH(CHOH)4-COH + Ag2O t. NH3→ СH2OH(CHOH)4-COOH + 2Ag↓ (глюконовая кислота)
Или СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓ + 3NH3 +H2O
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O
3. Восстановление:
СH2OH(CHOH)4-COH + H2 t, Ni → СH2OH(CHOH)4-CH2OH (сорбит – шестиатомный спирт)
III. Свойства многоатомных спиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
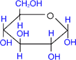 α - глюкоза
α - глюкоза
| + СH3ОН | HCl(газ)→ | 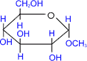
| + H2О |
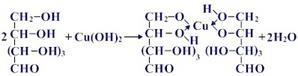
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
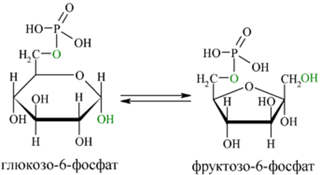
Превращение глю-6-фосфата во фруктозу-6-фосфат
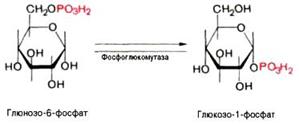
превращение глю-6-фосфата в глюкозу-1-фосфат
рибулозы-5-фосфата в ксилулозу-6-фосфат
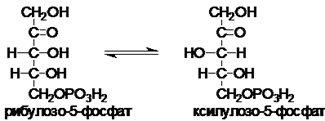
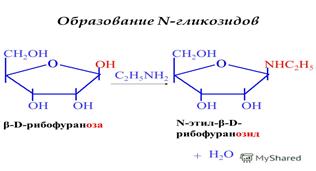
30. СТЕРЕОИЗОМЕРИЯ МОНОСАХАРИДОВ D- И L- РЯДЫ, ОТКРЫТЫЕ И ЦИКЛИЧЕСКИЕ ФОРМУЛЫ (ФИШЕРА, КОЛЛИ-ТОЛЛЕНСА, ХЕУОРСА), ПИРАНОЗЫ И ФУРАНОЗЫ, α И β АНОМЕРЫ, ЦИКЛОЦЕПНАЯ ТАУТОМЕРИЯ, ЯВЛЕНИЕ МУТАРОТАЦИИ.
|
|
|
МУТАРОТАЦИЯ — самопроизвольное изменение величины оптического вращения свежеприготовленных растворов оптически активных соединений. Характерна для моносахаридов, восстанавливающих олигосахаридов, лактонов и др. Катализируется кислотами и основаниями. Растворы гликозидов не мутаротируют.
В случае глюкозы мутаротация объясняется установлением равновесия:
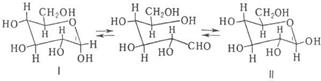
В равновесном состоянии присутствует 38% a-формы (ф-ла I) и 62% b-формы (II). Промежуточная альдегидная форма содержится в ничтожно малой концентрации. Преимуществ, образование b-формы объясняется тем, что гидроксил при С-1 занимает экваториальное положение.
Моносахариды могут существовать как в открытой (оксоформе), так и в циклических формах. В растворе эти изомерные формы находятся в динамическом равновесии.
Открытые формы. Моносахариды (монозы) являются гетерофункциональными соединениями. В их молекулах одновременно содержатся карбонильная (альдегидная или кетонная) и несколько гидроксильных групп, т. е. моносахариды представляют собой полигидроксикарбонильные соединения - полигидроксиальдегиды и полигидроксикетоны. Они имеют неразветвленную углеродную цепь.
Моносахариды классифицируют с учетом природы карбонильной группы и длины углеродной цепи. Моносахариды, содержащие аль- дегидную группу, называют альдозами, а кетонную группу (обычно в положении 2) - кетозами (суффикс -оза применяют для названий моносахаридов: глюкоза, галактоза, фруктоза и т. д. ). В общем виде строение альдоз и кетоз можно представить следующим образом.
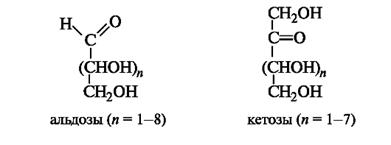
Для обозначения стереохимии используется D, L-система. Отнесение моносахарида к D- или L-ряду проводят по конфигурации хирального центра, наиболее удаленного от оксогруппы, независимо от конфигурации остальных центров! Для пентоз таким «определяющим» центром является атом С-4, а для гексоз - С-5. Положение группы ОН у последнего центра хиральности справа свидетельствует о принадлежности моносахарида к D-ряду, слева - к L-ряду, т. е. по аналогии со стереохимическим стандартом - глицериновым альдегидом. Большинство природных моносахаридов принадлежит к D-ряду. Из альдопентоз часто встречаются D-рибоза и D-ксилоза, а из кетопентоз - D-рибулоза и D-ксилулоза. Циклические формы. Открытые формы моносахаридов удобны для рассмотрения пространственных отношений между стереоизомерными моносахаридами. В действительности моносахариды по строению являются циклическими полуацеталями. Образование циклических форм моносахаридов можно представить как результат внутримолекулярного взаимодействия карбонильной и гидроксильной групп (см. 9. 2. 2), содержащихся в молекуле моносахарида.
|
|
|

Полуацетальную гидроксильную группу в химии углеводов называют гликозидной. По свойствам она значительно отличается от остальных (спиртовых) гидроксильных групп.
В результате циклизации образуются термодинамически более устойчивые фуранозные (пятичленные) и пиранозные (шестичленные) циклы. Названия циклов происходят от названий родственных гетероциклических соединений - фурана и пирана.
В циклической форме создается дополнительный центр хиральности - атом углерода, ранее входивший в состав карбонильной группы (у альдоз это С-1). Этот атом называют аномерным, а два соответствующих стереоизомера - α - и β -аномерами. Аномеры представляют собой частный случай эпимеров. У α -аномера конфигурация аномерного центра одинакова с конфигурацией «концевого» хирального центра, определяющего принадлежность к d- или l-ряду, а у β -аномера - противоположна. В проекционных формулах Фишера у моносахаридов d-ряда в α -аномере гликозидная группа ОН находится справа, а в β -аномере - слева от углеродной цепи.
Формулы Хеуорса. Циклические формы моносахаридов изображают в виде перспективных формул Хеуорса, в которых циклы показывают в виде плоских многоугольников, лежащих перпендикулярно плоскости рисунка. Атом кислорода располагают в пиранозном цикле в дальнем правом углу, в фуранозном - за плоскостью цикла. Символы атомов углерода в циклах не указывают.
|
|
|

Для перехода к формулам Хеуорса циклическую формулу Фишера преобразуют так, чтобы атом кислорода цикла располагался на одной прямой с атомами углерода, входящими в цикл. Это показано ниже на примере a-d-глюкопиранозы путем двух перестановок у атома С-5, что не изменяет конфигурацию этого асимметрического центра. Если преобразованную формулу Фишера расположить горизонтально, как требуют правила написания формул Хеуорса, то заместители, находившиеся справа от вертикальной линии углеродной цепи, окажутся под плоскостью цикла, а те, что были слева, - над этой плоскостью.
Химическая сущность мутаротации состоит в способности моносахаридов к существованию в виде равновесной смеси таутомеров - открытой и циклических форм. Такой вид таутомерии называется циклотаутомерией.
В растворах равновесие между четырьмя циклическими таутомерами моносахаридов устанавливается через открытую форму - оксоформу. Взаимопревращение a- и β -аномеров друг в друга через промежуточную оксоформу называется аномеризацией.
Таким образом, в растворе d-глюкоза существует в виде таутомеров: оксоформы и a- и β -аномеров пиранозных и фуранозных циклических форм.
|
|
|


