 |
Раствор I для выделения плазмидной ДНК
|
|
|
|
| Запасной раствор | Рабочий раствор (1 мл) | ||
| Требуемый объем | Конечная концентрация | ||
| 1 М трис-НС\ рН 80,5 М ЭДТА-Ыа, рН 8 Вода дистиллированная 6. Раствор | 25 мкл 25 мМ 20 мкл 10мМ До 1 мл (0,55 мкл) — II для выделения плазмидной ДНК | ||
| Запасной раствор | Шючий раствор (2 мл) | ||
| Требуемый объем | Конечная концентрация | ||
| 1 М №ОН10%-ный ДЦС-ЫаВода | 0,4 мл 0,2 мл 1,4 мл | 0,2 М 1% |
2. Колонии клеток кишечной палочки, выращенные на твердой питательной среде (при 37°С в течение ночи), собирают при помощи микробиологической петли с '/8—Ую части поверхности чашки Петри, суспендируют в 500 мкл дистиллированной воды в микропробирке вместимостью 1,5 мл."'3. Суспензию клеток центрифугируют 3 мин при 4000 #.
4. Супернатант отделяют декантацией, осадок ресуспендируют в 200 мкл раствора I и выдерживают 5—7 мин при комнатной температуре. К клеточной суспензии прибавляют 400 мкл раствора II и перемешивают быстрым пятикратным переворачиванием закрытой пробирки без встряхивания (содержимое при этом должно быть вязким и прозрачным), затем пробирку выдерживают 5 мин при 0—4 °С
6. К суспензии добавляют 200 мкл 5 М раствора ацетата калия (рН 4,8), содержимое пробирки перемешивают до формирования творожистого осадка, а затем выдерживают 5 мин при 4 °С в термостате с функцией охлаждения.
7. Содержимое пробирки центрифугируют 5 мин при 10 000 #.
8. Супернатант переносят в чистую микропробирку вместимостью 1,5 мл, добавляют 600мк лизопропанола (для осаждения ДНК) и аккуратно перемешивают, плавно переворачивая плотно закрытую пробирку.
9. Полностью однородный раствор инкубируют 10—15 мин при
комнатной температуре до появления беловатой хлопьевидной
взвеси в толще прозрачного раствора.
|
|
|
10. Содержимое пробирки центрифугируют 10 мин при 10 000 #.
11. Супернатант полностью удаляют, а полученный осадок
ДНК промывают в 100 мкл 70%-ного этанола, который затем полностью удаляют из пробирки.
12. Осадок ДНК подсушивают при 37°С, поместив открытую пробирку в термостат на 10 мин.
13. Высушенный осадок ДНК растворяют в 100 мкл буфера ТЕ.
14. Контроль качества выделенной ДНК производят с помощью электрофореза в агарозном геле (см. практическую работу № 2). При этом для нанесения на гель требуется 5 мкл раствора полученной пДНК. В качестве контрольных образцов вносят 5 мкл образцов ДНК плазмиды рСЕМ-32 (2743 п.н.) в концентрации 0,2; 0,5; 1,0 мкг/мкл, а также 5 мкл ДНК плазмиды рОЕМ-72Г(3000 п.н.).
15. Полученные результаты регистрируют визуально или с помощью гель-документирующей видеосистемы.
Контрольные вопросы. 1. Какими формами представлена ДНК бактериальной
клетки? 2. Какие участки плазмид отвечают за репликацию? 3. Каков принцип
щелочного метода разделения плазмидной и хромосомной ДНК? 4. Какие вещества применяют для очистки ДНК от РНК и белков? 5. Какое вещество используют для осаждения ДНК?
Задания. 1. Поместить схему или фотографию электрофореграммы в рабочий журнал, пронумеровать дорожки и сделать подписи к ним. 2. Сравнить электрофоретическую подвижность выделенной пДНК и ДНК плазмид рСЕМ-32, рСЕМ-72г", определить по электрофореграмме размер выделенной плазмидной ДНК,
используя маркеры молекулярных масс. 3. Сравнить интенсивность свечения в ультрафиолетовом свете выделенной пДНК и
контрольных образцов ДНК плазмиды рСЕМ-32 разной концентрации, определить по электрофореграмме примерную концентрацию выделенной плазмидной ДНК.
Практическая работа № 6
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ И КАЧЕСТВА
ПРЕПАРАТОВ НУКЛЕИНОВЫХ КИСЛОТ МЕТОДОМ
-СПЕКТРОФОТОМЕТРИИ
Оптическая плотность раствора нуклеиновых кислот при длине
волны 260 нм, равная 1, соответствует 50 мкг/мл двухцепочечных
ДНК и РНК, 40 мкг/мл одноцепочечных ДНК и РНК и 20 мкг/мл
олигонуклеотидов. По известной оптической плотности раствора
можно рассчитать концентрацию, мкг/мкл, по соответствующим
формулам:для двух цепей полинуклеотидов: АА260 х разбавление х 50/1000;
„,# для одиночных цепей ДНК: АА260 х разбавление х 37/1000;для одиночных цепей РНК: ААт х разбавление х 40/1000;для олигонуклеотидов: АА260 х разбавление х 20/1000,где АА2во — разница оптических плотностей раствора нуклеиновых кислот и ра-
створителя, которым практически всегда является стерильная деионизованная
вода. А2(,о деионизованной воды равна нулю, и этот ноль используют
для установления «оптического нуля» спектрофотометра, работа
которого основана на сравнении двух потоков света: один - через
растворитель, другой — через раствор. Применение стерильной
воды связано с тем, что присутствие в растворителе микрофлоры
или ферментов, разрушающих нуклеиновые кислоты (ДНКазы,
РНКазы), может привести к получению ошибочных результатов
измерений. Разбавление исходных растворов требуется для получения результатов измерений, лежащих в пределах шкалы оптической плотности спектрофотометра, так как с этим связана точность расчета концентраций нуклеиновых кислот. Указанное соответствие, установленное эмпирически, приведено далее.
|
|
|
| Значение АА2бо ~ 0,005 -0,01 0,1-1,0 0,3-0,7 >2,5 |
Ошибка, %
~ 18
~9
~ 1,0
~0,3
Требуется большее разбавление
Расчет концентрации олигонуклеотидных праймеров для ПЦР
осложняется тем, что конечные данные нужно выразить в молярных, а не массовых единицах, т. е. не мкг/мкл или нг/мкл, а в
пкмоль/мкл. Можно точно рассчитать молярную массу каждого из
используемых праймеров (для этого имеется ряд специальных
компьютерных программ), но, как показывает практика, высокой
точности здесь не требуется, вполне достаточно знать число нуклеотидов в праймере и получить соотношение пкмоль: нг из данных, представленных далее:
| Число звеньев олигонуклеотида | 100 нг соответствуют п пкмолям |
| 18,87 | |
| 17,54 | |
| 16,67 | |
| 15,87 | |
| 14,93 | |
| 12,50 | |
| 11,11 | |
Качество препарата нуклеиновой кислоты проще всего установить, сняв весь спектр поглощения ее раствора в ультрафиолетовой области (при условии, что полученный раствор бесцветен).
|
|
|
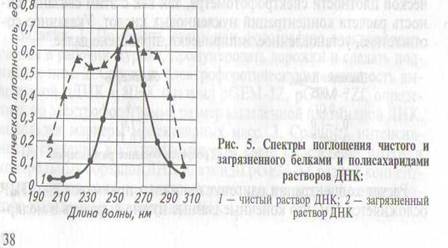
Никаких значительных пиков поглощения, кроме пика, полученного при 260 нм, быть не должно, а сам пик при этом должен
иметь классическую форму (рис. 5). Однако это неудобно, так как
построение полного спектра поглощения — процесс длительный
и не может быть использован для массовых измерений. Как показывает практика, вполне достаточно сопоставить значения оптической плотности раствора нуклеиновых кислот, полученные в двух точках: при 260 и 280 нм, где растворы чистой ДНК или РНК
поглощают очень мало, зато примеси становятся хорошо «заметными». В частности, водный раствор белка преимущественно поглощает именно при 280 нм, а, следовательно, при увеличении его доли в растворе нуклеиновой кислоты значение А2бо/А2»о Уменьшается. Белковые примеси практически всегда присутствуют в
препаратах высокомолекулярных нуклеиновых кислот, выделенных из природных объектов. Присутствие других примесей, смещающих значение ^2бо/^28О в сторону уменьшения ДНК, менее вероятно, но для повышения качества ДНК или РНК в таких препаратах рекомендуется произвести экстракцию примесей фенолом
и хлороформом (или повторить, если она уже произведена; см.
практическую работу № 3).
ДНК и белок незначительно поглощают в области спектра с
длиной волны менее 260 нм, но в растворе могут присутствовать и
другие соединения, в том числе биогенного происхождения, например полисахариды. Присутствие в растворе нуклеиновых кислот таких соединений можно выявить по смещениюзначенияЛ2бо/^28о от оптимального в сторону увеличения, однако избавиться от них полностью практически невозможно. Можно лишь
свести их содержание к минимуму путем переосаждения ДНК
или РНК из раствора в присутствии высокой концентрации солей (рекомендуется ацетат натрия,калия или аммония,хлорид лития).
Таким образом, раствор нуклеиновых кислот считается чистым, т. е. не содержащим белков и других примесей в аналитически значимых количествах, при значениях величины ^42бо/^28овэм~лирически установленных пределах 1,8—1,9 для раствора РНК,
1,9—2 для раствора ДНК. Для ПЦР и секвенирования пригодны
растворы ДНК со значениями Ак^/А2^, равными 1,6—2. Во всех
остальных случаях лучше исследовать спектр поглощения более
детально или определить параметры чистоты используемых растворов нуклеиновых кислот другими методами.
|
|
|
Цель работы. Освоить метод определения концентрации и степени чистоты растворов нуклеиновых кислот методом спектрофотометрии.
Оборудование и материалы. 1. Спектрофотометр с комплектом кварцевых кювет вместимостью 1 мл (длина оптического пути 1 см). 2. Растворы ДНК, РНК,
олигонуклеотидов (можно использовать, например, препараты, полученные выделением нуклеиновых кислот из природных объектов, — см. практические работы № 3—
5; ПЦР-фрагмент, очищенный методом препаративного электрофореза, — см. практические работы № 7, 8; смеси олигонуклеотидных праймеров для ПЦР). 3. Коммерческие препараты высокомолекулярных ДНК и РНК. 4. Стерильная деионизованная вода.
Ход работы. Определение концентрации и качества препарата геномной ДНК. 1. Для разведения образца геномной ДНК в 50 раз в чистую микропробирку вместимостью 1,5 мл вносят 20 мкл раствора ДНК, добавляют 980 мкл стерильной деионизованной воды и осторожно перемешивают. Переносят разбавленный раствор ДНКвкварцевуюкюветуспектофотометра, в другую (контрольную) кювету вносят стерильную деионизованную воду, использованную для разведения образца ДНК.
2. Производят измерение оптической плотности (поглощения,
абсорбции) раствора ДНК против растворителя (воды) при 260 нм
(ЛЛ)
4.Изменяют длину волны спектрофотометра на 280 нм и вновь
производят измерение оптической плотности раствора ДНК
5.Рассчитывают концентрацию ДНК в растворе, мкг/мкл, по формуле
С = АА2во х разбавление х 50/1000.(
6. Определяют чистоту препарата ДНК по формуле ЛЛ26о/ДЛ28о
и делают вывод о возможности использования препарата в дальнейшем.
Определение концентрации и качества препарата П Ц Р-фрагмента (предварительно очищенного методом препаративного электрофореза). 1. Для разведения образца продукта ПЦР в 20 раз в чистую микропробирку вместимостью 1,5 мл
вносят 50 мкл раствора ДНК, добавляют 950 мкл стерильной деионизованной воды и осторожно перемешивают.
2. Далее проводят процедуру спектрофотометрирования как в
пп. 2—4 (см. Определение концентрации и качества препарата геномной ДНК).
3. Рассчитывают концентрацию ПЦР-фрагмента в растворе,
мкг/мкл, по формуле
| С = |
х разбавление х 50/1000.
Определяют чистоту препарата ПЦР-фрагмента по формуле
А^2бо/А^28о и делают вывод о возможности использования препарата в дальнейшем.
|
|
|
Определение концентрации и качества препарата РНК. 1. В чистую микропробирку вместимостью 1,5мл
вносят 50 мкл раствора РНК, добавляют 950 мкл стерильной деионизованной воды и осторожно перемешивают.
2. Переносят разбавленный раствор РНК в кварцевую кювету, в
другую такую же кювету вносят стерильную деионизованную
воду, использованную для разведения образца РНК.
3. Измеряют оптическую плотность раствора РНК в сравнении
с растворителем (воды) при 260 нм (ДЛ260).
4. Рассчитывают концентрацию РНК в растворе, мкг/мкл, по
формуле
С = АА2во х разбавление х 40/1000.
Определение концентрации и качества олигодезоксирибонуклеотидов (праимеров для ПЦР).
1.В чистую микропробирку вместимостью 1,5 мл вносят 50 мкл раствора олигонуклеотидов, добавляют 950 мкл стерильной деионизованной воды и осторожно перемешивают.
2. Переносят разбавленный раствор олигонуклеотидов в кварцевую кювету, в другую такую же кювету вносят стерильную деионизованную воду, использованную для разведения образца.
3. Производят измерение оптической плотности раствора олигонуклеотидов против растворителя (воды) при 260 нм (АЛ260).
4. Рассчитывают концентрацию олигонуклеотидов в растворе,
мкг/мкл, по формуле
С = АА260 х разбавление х 20/1000
и с использованием данных на с. 38 переводят массовые единицы
в молярные.
Контрольные вопросы. 1. В чем принцип метода спектрофотометрического определения концентраций нуклеиновых кислот? 2. Есть ли отличие в поглощении
растворов ДНК и РНК с одинаковой концентрацией? 3. Можно ли использовать
для спектрофотометрии нуклеиновых кислот широко распространенные пластиковые кюветы? 4. Почему обязательно нужно использовать стерильную деионизованную воду для разведения растворов нуклеиновых кислот?
Задания. 1. Рассчитать величины необходимых разбавлений растворов нуклеиновых кислот и олигонуклеотидных праимеров для проведения ПЦР.
2.Сопоставить показатели качества препаратов ДНК и РНК для полученных самостоятельно на практикуме и коммерческих препаратов. Сделать вывод о возможности их дальнейшего использования для ПЦР.
Практическая работа №7
ПОСТАНОВКА ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ
Полимеразная цепная реакция (ПЦР) — метод амплификации(умножение числа копий) фрагментов нуклеиновых кислот туйго, с помощью которого можно избирательно и быстро получить миллионы копий определенных (целевых) нуклеотидных последовательностей. Этот метод, разработанный К. Мюллисом и Р. Сайки в 1985—1988 гг., был назван выдающимся изобретением века, а авторам его присудили Нобелевскую премию. Внедрение его позволило ускорить реализацию программы «Геном человека»,а также способствовало внедрению в практику клинической диагностики наследственных и паразитарных заболеваний высокоэффективных тестов нового поколения. В ПЦР для амплификации
фрагментов ДНК используют термоустойчивую ДНК-полимеразу из термофильной бактерии Ткегтт адиаНсш (Тад-полимеразу), которая в присутствии четырех видов дезоксирибонуклеозидтри-фосфатов (дАТФ, дГТФ, дЦТФ, дТТФ) и коротких 20—30-членных затравок (праймеры) осуществляет синтез омплементарныхпоследовательностей ДНК. В качестве матрицы для ПЦР используют тотальную ДНК или чаще ее фрагменты, полученные из исследуемого материала. В ходе ПЦР проводят термическую денатурацию двухцепочечной молекулы (фрагмент) ДНК при 93—95 °С, после чего пробы охлаждают до 60 "С, что дает возможность праймерам связаться с одноцепочечной ДНК. Праймеры подстраиваются сами (по комплементарному принципу) к денатурирован-
ным нагреванием гомологичным участкам одноцепочечных фрагментов исходной «материнской» ДНК и служат для двух целей: запускают работу Тод-полимеразы и одновременно ограничивают рост цепи ДНК, как бы застопоривают фермент в рамках нужного участка копирования ДНК. ПЦР имеет циклический характер.
В первом и частично во втором циклах образуются копии (ампликоны), не соответствующие границам амплифицируемого гена (все ампликоны в первом цикле и часть ампликонов во втором цикле получаются более протяженными в тех участках, где еще не произошло связывание второго, ограничивающего рост цепи праймера). Начиная с третьего цикла длина ампликонов становится стандартной, т. е. соответствует числу пар нуклеотидов ДНК-матрицы между З'-концами праймеров. Ампликоны накапливаются в геометрической прогрессии. Процесс имеет цепной характер, так как интезированные ампликоны в дальнейшем сами служат матрицей, на которой идет синтез. Повторяя циклы амплификации 30—40 раз, можно за 1,5—3 ч получить миллионы копий гена
(2", где п — число циклов амплификации) (рис. 6).
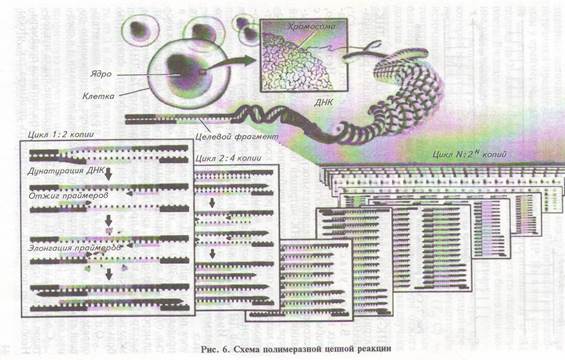
Подбор и оптимизация праймеров для ПЦР. Праймеры используют, как правило, попарно и подбирают их такимобразом,чтобы они были комплементарны противоположным цепям ДНК в участках, ограничивающих выбранную область, и ориентированы З'-кон-цами в направлении последовательности, которую необходимо
амплифицировать, т. е. навстречу друг другу (рис. 7). >
Оптимизация праймеров для ПЦР сводится к их «дизайну»
(выбору нуклеотидной последовательности) и определению оптимальной температуры для их отжига (связывание с ДНК-матрицей). Дизайн праймеров (т. е, выбор определенного участка на
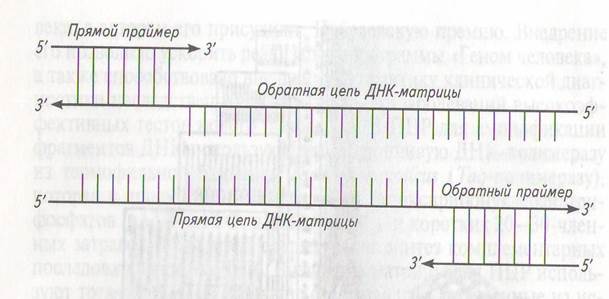
Рис. 7. Схема расположения ираймеров на ДНК-матрице для избирательной
(специфической) амплификации целевого фрагмента
ДНК-матрице для связывания с праймером) по известной ДНК-
матрице производится в соответствии со следующими рекомендациями:
Выбор участка на Д Н К-м а т р и ц е. Это один из са-мых важных шагов в планированииэксперимента.Необходимо,чтобы пара праймеров эффективно и специфично связывалась с искомой целевой последовательностью. Других вариантов связывания праймеров с ДНК-матрицей быть не должно, по крайней
мере для той ДНК, которую необходимо выделить из исследуемого материала (например, в пробах из крови человека будет присутствовать ДНК человека, возможно также ДНК некоторых микроорганизмов и простейших, но маловероятно присутствие геномной ДНК другого животного и тем более растения).
Информацию о последовательности нуклеотидов целевого
фрагмента (или только его концов) можно получить в базе данных международного генбанка(доступнанавеб-сайт\у\у\у.псЫ.п1гп.шп.§оу). Длина целевого фрагмента должна быть в пределах 100—3000 п.н., нижний предел обусловлен возможностью отделения амплифицированных фрагментов (ампликоны)отдимеров праймеров и других неспецифических фрагментов нэлектрофорезе, верхний предел — возможностями 7Ъ#ДНК-полимеразы, не способной эффективно синтезировать фрагменты большей длины.
Оптимальная длина праймеров. Этот показатель
определяется возможностью отжига праймера одновременно по
всей его длине и находится между 16 и 25 нуклеотидами и в среднем составляет 18—20 нуклеотидов.
Содержание ГЦ (ОС), %. Это отношение числа нуклеотидов дГ и дЦ (суммарно) к общему числу нуклеотидов праймера.
Необходимо подбирать последовательность праймера так, чтобызначение величины ОС (%) находилось между 35 и 65 (некоторые источники предлагают 45—55) и было приблизительно одинаковым у праймеров, составляющих пару для ПЦР. Ни в коем случае не должно оказаться несколько (3 и более) оснований дГ и дЦ подряд на З'-конце праймера: это сильно снижает его специфичность. В идеале все четыре нуклеотида должны быть более или менее равномерно распределены по всей длине праймера.
Температура отжига (Тапп °С). Это температура, при
которой вероятность связывания праймера с ДНК-матрицей превосходит 70 %. Для пары праймеров она на 4—5 "С (по некоторым
источникам на 2—4°С) ниже температуры плавления (Тт°С) —
температуры, при которой число связанных с ДНК и свободных
олигонуклеотидов одинаково. Оптимальная температура отжига
должна находиться в пределах 50—70°С (хотя в некоторых случаях
может быть и ниже) и не может различаться у праймеров, составляющих пару для ПЦР, более чем на 4 "С.
Рассчитать температуру плавления для подобраных праймеров
(°С) можно по формулам
Тт = 2(АТ)+4(ГЦ) — для праймеров до 20 н.;
Тт = 69,3+0,41(% GС)-650/ Í, — для праймеров более 20 н.,
где 1 — длина праймера.
Ориентировочную температуру отжига для каждой пары праймеров можно рассчитать, исходя из минимальной температуры плавления (на 2—4 "С ниже), рассчитанной для каждого их двухпраймеров, но точно ее установить можно только эмпирически по
результатам серии ПЦР, проведенных с разной температурой отжига, начиная с расчетной и ниже с шагом 1—2 "С.
Вторичная структура праймеров и целевого
фрагмента. Связывание праймеров с матрицей будет затруднено, если в месте связывания цепь ДНК может образовывать вторичные структуры — гомо-, гетеродимеры и петли. В связи с этимнеобходимо подбирать праймеры так, чтобы составляющие пару
олигонуклеотиды не содержали в своем составе последовательности из 3 и более нуклеотидов подряд, комплементарных аналогичной последовательности этого же (гомодимер) или другого (гетеродимер) праймера, а также палиндромных последовательностей,являющихся причиной образования петель. Заранее предвидеть
вторичную структуру целевого фрагмента (ампликон) практически невозможно, поэтому для его эффективной амплификации часто требуется испытать не одну, а две—четыре и более пар праймеров, пока не будет достигнут искомый результат
Расчет количества праймеров для ПЦР-смеси. Производители,синтезирующие праймеры на заказ, как правило, указывают концентрацию праймера в полученном растворе, например 33 пмоль/мклили 33 мМ. Для приготовления реакционной смеси требуется, какправило, 5—10 пмоль каждого из пары праймеров. Исходя из этой
величины и концентрации праймера, определяют объем исходного раствора праймера, который необходимо добавить в реакционную смесь, по формуле
| Объем раствора праймера, мкл = - |
Требуемое
количество праймера, пмоль
Концентрация
праймера, пмоль/мкл
При этом нет необходимости оперировать с очень малыми
объемами (1 мкл и менее) раствора праймеров и других компонентов реакционной смеси для ПЦР, поскольку это практически невозможно реализовать. Объем исходного раствора праймеров рассчитывают и добавляют к суммарному объему реакционной смеси,
приготовленному для 10 и более реакций, или разбавляют исходный раствор стерильной деионизованной водой до требуемой концентрации и смешивают оба праймера в одной пробирке (только аликвоты, а не весь объем исходных растворов праймеров!).
Приготовление реакционной смеси и проведение ПЦР. Помимо
ДНК-полимеразы (1 ед. акт/реакцию), праймеров и ДНК-матрицы в реакционной смеси должны присутствовать: 1) смесь всех четырех дезоксинуклеозидтрифосфатов в конечной концентрации,как правило, 0,25 мМ каждого; 2) катионы Мg2+ как необходимый кофактор ДНК-полимеразы (используют раствор МgС12 в конечной концентрации 1,5—3 мМ, оптимальную концентрацию подбирают экспериментально в соответствии с применяемым типом ДНК-полимеразы и числом одновременно амплифицируемых продуктов); 3) 5—10 мМ трис-ЯС\ буферный раствор рН 8—10
(обычно прилагается к любому коммерческому препарату ДНК-
полимеразы и оптимизирован для нее); 4) соли КС1, NaСIдля
обеспечения необходимой ионной силы раствора входят в состав
буферного раствора для ДНК-полимеразы; 5) неионный детергент
Тweп20 для предотвращения адсорбции молекул ДНК-полимеразы на стенках реакционной посуды (как правило, пробирки из полиэтилена); 6) иногда дополнительно бычий сывороточный альбумин (БСА), ди- и олигосахариды для стабилизации ДНК-полимеразы, формамид (для повышения специфичности гибридизации
праймеров с ДНК-матрицей) и др.
Таким образом, очевидно, что типичная процедура «сборки»
смеси для ПЦР весьма сложна (доступна только опытному оператору), продолжительна (что критично для сохранения реагентов в неразрушенном состоянии) и требовательна к точности (иначе невозможно обеспечить воспроизведение результатов). Поэтому в посление 10—15 лет для ПЦР широко применяют готовые к употреблению смеси, включающие все необходимые компоненты, кроме
праймеров (но, например, наиболее широко употребимые ПЦР-смеси для обнаружения ДНК патогенной микрофлоры содержат
также и праймеры) и ДНК-матрицы, жидкие или лиофилизированные. Одной из таких является предлагаемая для практикума смесь
«ПЦР-ядро» производства ООО «КОМПАНИЯ «БИОКОМ».
В ходе ПЦР каждая из вновь синтезируемых с помощью одного
из праймеров молекул ДНК может служить матрицей для синтеза
комплементарной цепи ДНК с помощью другого праймера. Для
этого надо денатурировать образовавшиеся на первой стадии реакции двухцепочечные молекулы ДНК, дать возможность новым
праймерам комплементарно присоединиться к ДНК и осуществить синтез (элонгацию).
Цикл ПЦР (амплификация) включает:
этап 1 — денатурация (плавление) ДНК-матрицы при 92—95 °С;
этап 2 — связывание (отжиг) праймеров с одноцепочечными
фрагментами ДНК-матрицы при 55—65 °С;
этап 3 — ферментативный синтез комплементарных цепей
ДНК (элонгация) при 72 °С.
Следующий цикл ПЦР составляют те же самые этапы, причем
матрицей для синтеза новых молекул ДНК может служить каждая
из вновь синтезированных цепей ДНК. В результате ПЦР приведет к экспоненциальному росту количества именно таких, ограниченных с двух сторон праймерами, молекул ДНК (см. рис. 7). Реализовать все шаги цикла в автоматическом режиме позволяют специальные приборы — термоциклеры (программируемые термостаты, амплификаторы).
Для упрощения процедуры приготовления реакционной смеси
для ПЦР созданы специальные наборы реагентов для амплификации, включающие все необходимые компоненты, в том числе
ДНК-полимеразу, которые уже смешаны в нужных пропорциях.
В реакционную смесь для ПЦР требуется добавить лишь ДЩС-матрицу и праймеры (в некоторых случаях праймеры также могут входить в состав наборов), что существенно экономит рабочее время и снижает вероятность ошибок и контаминации.
Известно, что чувствительность ПЦР может достигать теоретически возможного предела (единичная молекула ДНК-матрицы).Это позволяет выявлять целевой фрагмент, используя микроскопически малые количества исходного материала. Однако у этой
полезной особенности ПЦР есть и оборотная сторона — высокая
степень опасности получения ложноположительных результатов из-за контаминации, т. е. загрязнения реакционной смеси посторонней ДНК-матрицей или амплифицированными фрагментами(ампликонами).
Основные причины получения ложноположительных результатов при постановке ПЦР таковы:
перекрестная контаминация от пробы к пробе (например,впроцессе обработки клинических образцов или при раскапыванииреакционной смеси);
контаминация рекомбинантными плазмидами, содержащими копии клонированной последовательности целевого фрагмента (эти плазмиды чаще всего используются в качестве положительного контроля ПЦР);
контаминация ампликонами — наиболее частая причина ложноположительных результатов, так как в процессе ПЦР ампликоны накапливаются в больших количествах и очень легко переносятся с аэрозолями, через приборы, инструменты, одежду и т. д.
Цель работы. Ознакомиться с методом полимеразной цепной
реакции (ПЦР).
Оборудование и материалы. 1. Термоциклер (ДНК-амплификатор). 2. Микроцентрифуга-вортекс (до 2000#). 3. Термостат твердотельный с функцией охлаждения для микропробирок вместимостью 0,5—1,5 мл. 4. УФ-бокс. 5. Автоматические
дозаторы переменного объема с наконечниками. 6. Материалы и оборудование
для проведения электрофореза, представленные в практической работе № 2.
7. Набор реагентов для амплификации ДНК (ООО «КОМПАНИЯ «БИОКОМ»):
микропробирки, содержащие лиофилизированную амплификационную смесь
«ПЦР-ядро»; ПЦР-растворитель; смесь праймеров (например, для определения
фрагмента гена 185 рРНК) готовят самостоятельно или входит в состав смеси; положительный контроль (раствор стандартной ДНК) подбирается самостоятельно
или входит в состав смеси; масло минеральное. 8. Растворы ДНК-матрицы (образцы ДНК, выделенные из прокариот или эукариот — см. практические работы
№ 3—5). 9. Вода дистиллированная. 10. Перчатки резиновые или латексные, неопудренные.
Ход работы. Внимание! Все манипуляции производить только в
перчатках! Наконечники для автоматического дозатора необходимо
использовать однократно!
1. Извлекают из пакета необходимое количество пробирокПЦР-ядро (оно равно числу анализируемых проб плюс положительный и отрицательный контроль), размещают их в штативе и маркируют. Обратите внимание, на дне каждой пробирки находится лиофилизированная смесь синего цвета, которая затем должна быть полностью растворена. Положительным контролем (К+) служит раствор, образуемый стандартной ДНК (см. далее). Отрицательный контроль (К—) — ТЕ-буфер из комплекта, спользован-ного для выделения ДНК.
2. Добавляют в каждую пробирку ПЦР-ядро по 10 мкл ПЦР-растворителя.
3. Добавляют в каждую пробирку ПЦР-ядро 5 мкл смеси праймеров, например для определения гена 18S рРНК:
прямой праймер (1): 5'-АGC САТ GСА ТGТ GТА АGТ АТG ААС G-З',
обратный праймер (2): 5'-GСС СGG ТАТ ТGТ ТАТ ТТА ТТG
ТСА СТ-3'.
Можно предложить измерить концентрацию праймеров и приготовить их рабочую смесь, содержащую по Юпмоль каждого праймера в 5 мкл раствора, самостоятельно следуя указаниям, которые изложены в практической работе № 6. Аналогично пригото-вить положительный контроль, используя раствор ДНК (20—50 нг/мкл), выделенной из растительной или животной ткани любым из приведенных ранее способов.
4. Содержимое пробирок перемешивают, встряхивая на вортексе, до полного растворения сухих компонентов смеси. Обычно для этого требуется 5-10 мин, после чего жидкость в пробирке должна равномерно окраситься в синий цвет.
5. Добавляют в пробирки с амплификационной смесью:
• в пробирку с маркировкой К— (отрицательный контроль) —
5 мкл ТЕ-буфера из комплекта, использованного для выделения
ДНК;
• в пробирки с маркировкой №... (исследуемые образцы) — по
5 мкл пробы соответствующей ДНК-матрицы;
• в пробирку с маркировкой К+ (положительный контроль) —
5 мкл раствора стандартной ДНК.
6. Содержимое всех пробирок еще раз аккуратно перемешивают.
7. Во все пробирки добавляют по 20-25 мкл (две капли) минерального масла, пробирки плотно закрывают крышечками.
8. Пробирки центрифугируют 5—7 с при 2000g. При этом отдельные капли ПЦР-смеси, оказавшиеся при ее перемешивании
на стенках и крышке пробирки, должны быть сброшены на дно, а
сверху ровно наслоено минеральное масло.
9. Пробирки с готовой ПЦР-смесью помещают в амплификатор и запускают программу амплификации (контроль температуры в термоблоке амплификатора должен осуществляться в режимеактивного регулирования температуры):
94 °С — 3 мин;
35 циклов, включающих:
94 oС (денатурация) — 40 с,
58 oС (отжиг праймеров) — 30 с,
72 °С (элонгация) — 40 с;
72 °С — 4 мин.
10.По окончании амплификации пробирки извлекают из амплификатора, помещают в штатив и переносят в зону для электрофореза продуктов ПЦР.
ПЦР-продукты (ампликоны) можно использовать в других практических работах и хранить в течение 1—2 нед при —18 °С.
11. Детекцию результатов ПЦР производят с помощью электрофореза в агарозном геле (практическая работа № 2). \
12. Полученные результаты регистрируют визуально или с помощью видеосистемы.
Контрольные вопросы. 1. Каков принцип метода ПЦР? 2. Из каких этапов состоит цикл ПЦР? 3. Из каких компонентов состоит реакционная смесь? 4. Каковы
основные причины получения ложноположительных результатов при проведении
ПЦР? 5. Какие контроли и с какой целью используют при постановке ПЦР? 6. В
какой очередности осуществляют внесение образцов и контролей в ПЦР-смесь? 7.
Как должны выглядеть зоны положительного и отрицательного ПЦР-контролей
на геле? 8. В каком случае образцы следует считать положительными или отрица-тельными? 9. В каком случае результаты ПЦР-анализа считаются недействительными?
Задания. 1. Поместить схему или фотографию полученной
электрофореграммы в рабочий журнал, пронумеровать дорожки и
сделать подписи к ним. 2. Сделать вывод о наличии или отсутствии фрагмента гена 185 рРНК в исследуемых образцах ДНК и
определить его примерную молекулярную массу. 3. Подобрать
пару праймеров для амплификации фрагмента ДНК длиной около
1000 п.н. по заданной матрице:
|
|
|


